1) Um corpo possui massa de 500 gramas e calor específico 0,4 g/cal ºC . Determinar:
a) A quantidade de calor que o corpo deve receber para que sua temperatura varie de 5 ºC para
35 ºC;
b) A quantidade de calor que o corpo deve ceder para que sua temperatura diminua de 15 ºC.
Dados do problema
• massa do corpo: m = 500 g;
• calor específico: c = 0,4 g/cal ºC.
Solução:
a) Sendo a temperatura inicial t i = 5 ºC e a temperatura final t f = 35 ºC a quantidade de calor que
o corpo deve receber para que ocorra o aquecimento será dada por
Q = m c Δ t
Q = m c (t f - t i)
Q = 500 * 0,4 * (35 - 5)
Q = 200 * 30 = 6000 cal
b) Se o calor é cedido Δt < 0 , portanto, a variação deve ser Δt = −15 ºC e o calor cedido
será dado por
Q = m c Δt
Q = 500.0,4.(35−15)
Q =−3000 cal
Observação: no item (a) a temperatura varia de um valor inicial t i para um valor final t f,
conhecemos os valores inicial e final da temperatura. No item (b) a temperatura varia de um
certo valor, conhecemos a variação Δt sem conhecermos os valores inicial e final da
temperatura.
2) Um bloco de uma material desconhecido e de massa 1kg encontra-se à temperatura de 80°C, ao ser encostado em outro bloco do mesmo material, de massa 500g e que está em temperatura ambiente (20°C). Qual a temperatura que os dois alcançam em contato? Considere que os blocos estejam em um calorímetro.
Solução:
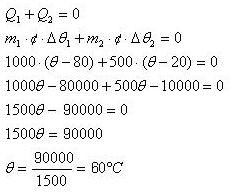
3) Qual a quantidade de calor absorvida para que 1L d'água congelado e à -20°C vaporize e chegue a temperatura de 130°C.
Dados:
Calor latente de fusão da água: L=80cal/g
Calor latente de vaporização da água: L=540cal/g
Calor específico do gelo: c=0,5cal/g.°C
Calor específico da água: c=1cal/g.°C
Calor específico da água: c=0,48cal/g.°C
Densidade da água: d:1g/cm³
1L=1dm³=1000cm³
Solução:
m=d.V
m=1000g
4) Um bloco de ferro de 10cm³ é resfriado de 300°C para 0°C. Quantas calorias o bloco perde para o ambiente?
Dados: densidade do ferro=7,85g/cm³ e calor específico do ferro=0,11cal/g.°C
O primeiro passo é descobrir a massa do bloco, sabendo sua densidade e seu volume (é importante prestar bastante atenção nas unidades de cada grandeza).
Solução:
Conhecendo a massa, podemos calcular a quantidade de calor do corpo:
Como Q<0, a transferência de calor acontece no sentido do bloco para o meio ambiente (libera calor).
5) Em uma cozinha, uma chaleira com 1L de água ferve. Para que ela pare, são adicionados 500mL de água à 10°C. Qual a temperatura do equilíbrio do sistema?
Qualquer quantidade de água que esteja fervendo encontra-se à temperatura de 100°C, se a temperatura for superior a esta, não haverá água líquida, apenas vapor.
Solução:
6) (FUVEST) Um ser humano adulto e saudável consome, em média, uma potência de 120J/s. Uma “caloria alimentar” (1kcal) corresponde, aproximadamente, a 4,0 x 103J. Para nos mantermos saudáveis, quantas “calorias alimentares” devemos utilizar, por dia, a partir dos alimentos que ingerimos?
a) 33
b) 120
c) 2,6x103
d) 4,0 x103
e) 4,8 x105
Solução:
P = Q / t , onde Q está em Joules (J) e t em segundos.
Se um ser humano consome 120 J em 1 segundo, quanto ele consumirá em 86400 segundos ( 1 dia).
120J -----------1s
X-----------86400s
X-----------86400s
Multiplicando cruzado, temos:
X = 120 . 86400
X = 10368000 J
Agora temos que passar isto para kcal, ou seja, outra regra de três:
1kcal----------------- 4,0 x 103J
Y-----------------------------10368000J
Y = 10368000 / 4,0 x 103J
Y = 2592 kcal
Colocando em notação científica:
Y = 2,6x 103 kcal. Letra C
7) (MACKENZIE) Uma fonte calorífica fornece calor continuamente, à razão de 150 cal/s, a uma determinada massa de água. Se a temperatura da água aumenta de 20ºC para 60ºC em 4 minutos, sendo o calor especifico sensível da água 1,0 cal/gºC, pode-se concluir que a massa de água aquecida, em gramas, é:
a) 500
b) 600
c) 700
d) 800
e) 900
Solução:
P = Q/t
A potência é dada e vale 150cal/s, o tempo também é dado e vale 240s, e o Q é o calor sensível, ou seja Q = mc(T-T0), logo substituindo:
P = mc(T-T0)/t
m = P.t/ c(T-T0)
m = 150.240/1,0.(60-20)
m = 900g Letra e
8) (UFPR) Durante o eclipse, em uma das cidades na zona de totalidade, Criciúma-SC, ocorreu uma queda de temperatura de 8,0ºC. (Zero Horas – 04/11/1994) Sabendo que o calor específico sensível da água é 1,0 cal/gºC, a quantidade de calor liberada por 1000g de água, ao reduzir sua temperatura de 8,0ºC, em cal, é:
a) 8,0
b) 125
c) 4000
d) 8000
e) 64000
Solução:
Q = mc(T-T0)
A temperatura cai 8,0°C, ou seja, T - T0 = 8,0°C
Q = 1000.1.8
Q = 8000 cal
9) (UFSE) A tabela abaixo apresenta a massa m de cinco objetos de metal, com seus respectivos calores específicos sensíveis c.
METAL
|
c(cal/gºC)
|
m(g)
|
Alumínio
|
0,217
|
100
|
Ferro
|
0,113
|
200
|
Cobre
|
0,093
|
300
|
Prata
|
0,056
|
400
|
Chumbo
|
0,031
|
500
|
O objeto que tem maior capacidade térmica é o de:
a) alumínio
b) ferro
c) chumbo
d) prata
e) cobre
Solução:
Bem, a quantidade de calor é calculada da seguinte forma:
Q = mc(T-T0),
porém o fator "mc" é conhecido como capacidade calorífica do corpo, uma vez que é medido a quantitadade de calor, por variação de temperatura. Assim a equação fica:
Q = C (T-T0), onde C (maiúsculo é a capacidade térmica).
Assim: C = mc, logo calculando a Capacidade térmica para todos os elementos citados à cima, podemos distinguir aquele que tem a maior capacidade térmica:
Calumínio= 0,217 . 100 = 21,7 cal/°C
Cferro=0,113 . 200 = 22,6 cal/°C
CCobre= 0,093 . 300 = 27,9 cal/°C
CPrata= 0,056 . 400 = 22,4 cal/°C
Cchumbo = 0,031 . 500 = 15,5 cal/°C
Assim podemos ver que o maior valor de capacidade térmica é o Cobre, letra E.
10) (MACKENZIE) Um bloco de cobre (c = 0,094 cal/gºC) de 1,2kg é colocado num forno até atingir o equilíbrio térmico. Nessa situação, o bloco recebeu 12 972 cal. A variação da temperatura sofrida, na escala Fahrenheit, é de:
a) 60ºF
b) 115ºF
c) 207ºF
d) 239ºF
e) 347ºF
Solução:
Q = mc(T-T0)
12 972 = 1200.0,094.(T-T0)
(T-T0) = 12972 / 112,8
(T-T0) = 115°C
Convertendo isso em Fahrenheit:
(C/5) = (F-32) / 9
(115 / 5) = (F-32) / 9
F - 32 = 9. 23
F = 207 + 32
F = 239 °F
Letra d
11) (MACKENZIE) Quando misturamos 1,0kg de água (calor específico sensível = 1,0cal/g°C) a 70° com 2,0kg de água a 10°C, obtemos 3,0kg de água a:
a) 10°C
b) 20°C
c) 30°C
d) 40°C
e) 50°C
Solução:
Bem a quantidade de calor cedida pela água mais quente (à 70°C), será a mesma quantidade de calor recebida pela água mais fria (à 10°C), assim:
Q1 + Q2 = 0
Q1 = 1000.1,0(T - 70)
Q2 = 2000.1,0 (T - 10)
logo:
1000(T-70) + 2000(T-10) = 0
1000(T-70) = - 2000(T-10)
T - 70 = -2000(T-10)/1000
T - 70 = -2 (T-10)
T - 70 = -2T +20
T + 2 T = 20 + 70
3T = 90
T = 30°C
Letra C
Lembrar sempre em por a massa em gramas.
12) (PUCCAMP) Uma barra de cobre de massa 200g é retirada do interior de um forno, onde estava em equilíbrio térmico, e colocada dentro de um recipiente de capacidade térmica 46cal/°C que contém 200g de água a 20°C. A temperatura final de equilíbrio é de 25°C. A temperatura do forno, em °C, é aproximadamente igual a: Dado: CCu = 0,03 cal/g°C
Solução:
Utilizando a mesma lógica do exercício 5, resolveremos este, porém agora o recipiente participa da troca de calor, logo:
Q1 + Q2 + Q3 = 0
Q1 = 200.0,03 (25-T0)
Q2 = 46(25-20) =230 cal (uma vez que 46 é a capacidade térmica e não o calor específico)
Q3 = 200.1.(25-20) = 1000cal
Assim:
6(25-T0)+230+1000=0
150 - 6T0 = -1230
- 6T0 = - 1230 - 150
- 6T0 = -1380
T0 = -1380/(-6)
T0 = 230°C
13) (UFPB) Um engenheiro testa materiais para serem usados na fabricação da carroceria de um automóvel. Entre outras propriedades, é desejável a utilização de materiais com alto calor específico. Ele verifica que, para aumentar em 3ºC a temperatura de 32 g do material A, é necessário fornecer 24 cal de calor a esse material. Para obter Para obter o mesmo aumento de temperatura em 40 g do material B, é preciso 24 cal. Já 50 g do material C necessitam de 15 cal para sofrer o mesmo acréscimo de temperatura. Os calores específicos dos materiais A, B, C, são respectivamente:
a) CA = 0,25 cal/ g ºC: CB = 0,20 cal/g ºC; CC = 0,10 cal/g ºC
b) CA = 0,20 cal/ g ºC; CB = 0,35 cal/g º C; CC = 0,15 cal/ g ºC
c) CA = 0,30 cal/ g ºC; CB = 0,10 cal/ g ºC; CC = 0,20 cal/ g ºC
d) CA = 0,35 cal/ g ºC; CB = 0,20 cal/ g ºC; CC = 0,10 cal/ g ºC
e) CA = 0,10 cal/ g ºC; CB = 0,30 cal/ g ºC; CC = 0,25 cal/ g ºC
Solução:
Material A Material B Material C
Q = m.c.ΔΘ 24 = 40.c.3 15 = 50.c.3
24 = 32.c.3 24 = 120.c 15 = 150.c
c = 24/96 c = 24/120 c = 15/150
c = 0,25 cal/ g ºC c = 0,2 cal g ºC c = 0,1 cal/ gºC
14) (UERJ) A quantidade de calor necessária para ferver a água que enche uma chaleira comum de cozinha é, em calorias, da ordem de:
a) 10^2 b) 10^3 c) 10^4 d) 10^5
1L = 1kg
Q = 1000.1.100
Q = 10^5 Letra D.
15) Com o objetivo de economizar energia, um morador instalou no telhado de sua residência um coletor solar com capacidade de 1,2 × 108 cal/dia. Toda essa energia foi utilizada paraaquecer 2,0 × 103 L de água armazenada em um reservatório termicamente isolado. De acordo com esses dados, a variação da temperatura da água (em graus Celsius) ao final de um dia é de:
Dados:Calor específico da água ca = 1,0 cal/g ºC
Densidade da água da = 1,0 g/cm³
A) 1,2 B) 6,0 C) 12,0 D) 60,0 E) 120, 0
Solução:
Como a densidade da água é 1,0 g / cm³ (que equivale a 1,0 kg / litro), 2000 litros dessa substância pesarão 2000 kg, ou 2000000 gramas.
m = 2,0 . 10³ kg = 2,0 . 10^6 g
Calor específico = 1 cal / g Cº
Q = 1,2 . 10^8 cal (capacidade diária)
Q = m . c . Δ t
Δ t = Q / m . c
Δ t = 1,2 . 10^8 / (2,0 . 10^6 . 1,0)
Δ t = 0,6 . 10² Δ t = 60º C Letra D.

a) mAl = 4mFe. b) mAl = 2mFe. c) mAl = mFe. d) mAl = mFe/2. e) mAl = mFe/4.
Solução:




a) 1,2. b) 1,5. c) 1,8. d) 2,0. e) 2,5.
a) Quais as temperaturas da água e do óleo no instante t=1,5 minutos?
a) Qual a razão entre os calores específicos da água e do óleo?



a) 420 cal b) 370 cal c) 320 cal d) 270 cal e) 220 cal
32) (UNICAMP-SP) Um rapaz deseja tomar banho de banheira com água à temperatura de 30°C, misturando água quente e fria.
Inicialmente, ele coloca na banheira 100 litros de água fria a 20°C. Desprezando a capacidade térmica da banheira e a perda de calor da água, pergunta-se:
a) quantos litros de água quente, a 50°C, ele deve colocar na banheira?
b) se a vazão da torneira de água quente é de 0,20 litros/s, durante quanto tempo a torneira deverá ficar aberta?
Solução:
a) maf.c.(te –to) + maq.c.(te – to)=0 --- 100.c.(30 - 20) + maq.c.(30 - 50)=0 --- 100.c.(10) + maq.c.(-20)=0 --- maq=50L
b) 0,20L – 1s --- 50L – t s --- 0,2t=50 --- t=250s=4min e 10s
33) (FUVEST) Um ser humano adulto e saudável consome, em média, uma potência de 120J/s. Uma “caloria alimentar” (1kcal) corresponde, aproximadamente, a 4,0 x 103J. Para nos mantermos saudáveis, quantas “calorias alimentares” devemos utilizar, por dia, a partir dos alimentos que ingerimos?
a) 33 b) 120 c) 2,6x10³ d) 4,0 x10³ e) 4,8 x105
Solução:
P = Q / t , onde Q está em Joules (J) e t em segundos.
Se um ser humano consome 120 J em 1 segundo, quanto ele consumirá em
86400 segundos ( 1 dia).
120J -----------1s
X-----------86400s
Multiplicando cruzado, temos:
X = 120 . 86400
X = 10368000 J
Agora temos que passar isto para kcal, ou seja, outra regra de três:
1kcal----------------- 4,0 x 103J
Y-----------------------------10368000J
Y = 10368000 / 4,0 x 103J
Y = 2592 kcal
Colocando em notação científica:
Y = 2,6x 103 kcal. Letra C
34) (UFPR) Durante o eclipse, em uma das cidades na zona de totalidade, Criciúma-SC, ocorreu uma queda de temperatura de 8,0ºC. (Zero Horas – 04/11/1994) Sabendo que o calor específico sensível da água é 1,0 cal/gºC, a quantidade de calor liberada por 1000g de água, ao reduzir sua temperatura de
8,0ºC, em cal, é:
a) 8,0 b) 125 c) 4000 d) 8000 e) 64000
Solução:
Q = mc(T-T0)
A temperatura cai 8,0°C, ou seja, T - T0 = 8,0°C
Q = 1000.1.8
Q = 8000 cal
m = 1kg = 1000 g
Q = + 400 cal
t0 = 10 0C
tf = 60 0C.
a)
A variação de temperatura da substância é dada por:
∆t = tf - t0
∆t = 60 – 10
∆t = 50 0C
Pela equação da quantidade de calor obtemos o calor específico da substância:
Q = m.c.∆t
400 = 1000 . c . 50
400 = 50 000 . c
400 / 50 000 = c
c = 0,008 (cal / g . 0C )
b)
A capacidade térmica é obtida pela equação C = m.c, logo:
C = m.c
C = 1000 . 0,008
C = 8 cal/0C
Respostas :
a) c = 0,008 (cal / g . 0C )
b) C = 8 cal/0C
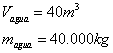
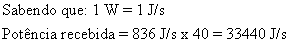

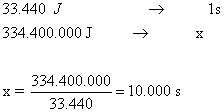
38) Um béquer, de massa desprezível, contém 500g de água á temperatura de 80ºC. Quantas gramas de gelo à temperatura de -40ºC devem ser adicionados à água para que a temperatura final da mistura seja de 50ºC?
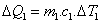
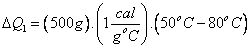
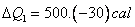
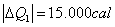

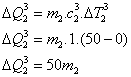
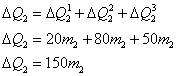
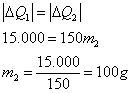
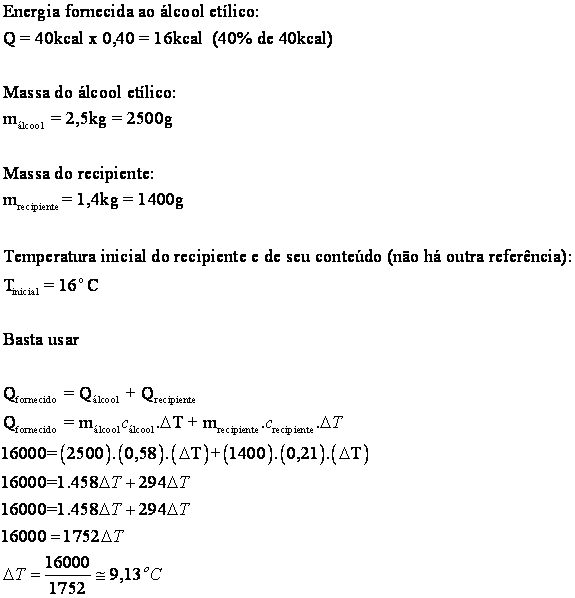
40) Um recipiente de capacidade térmica 50 cal/ºC contém 200g de água a 40ºC. Introduz no recipiente 50g de gelo a 0ºC. Admitindo q não há trocas de calor com o ambiente, a temperatura final de equilíbrio, em ºC, é:
Dados:
calor especifico da água = 1cal/gºC
calor latente de fusão de gelo = 80 cal/g
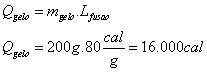
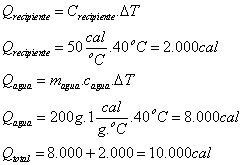
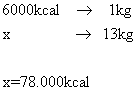
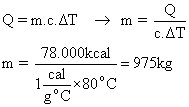
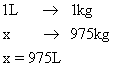
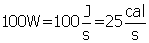
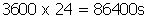
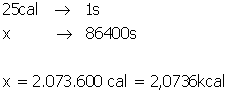
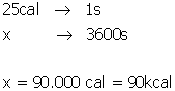

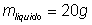
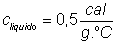
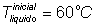
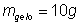
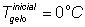
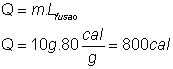
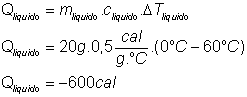
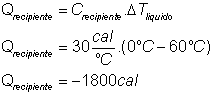

m = 2,0 . 10³ kg = 2,0 . 10^6 g
Calor específico = 1 cal / g Cº
Q = 1,2 . 10^8 cal (capacidade diária)
Q = m . c . Δ t
Δ t = Q / m . c
Δ t = 1,2 . 10^8 / (2,0 . 10^6 . 1,0)
Δ t = 0,6 . 10² Δ t = 60º C Letra D.
16) (UFRGS-010) Um corpo de alumínio e outro de ferro possuem massas mAl e mFer respectivamente. Considere que o calor específico do alumínio é o dobro do calor específico do ferro.

Se os dois corpos, ao receberem a mesma quantidade de calor Q, sofrem a mesma variação de temperatura ∆T, as massas dos corpos são tais que
a) mAl = 4mFe. b) mAl = 2mFe. c) mAl = mFe. d) mAl = mFe/2. e) mAl = mFe/4.
Solução:
Dados --- QAl = QFe --- cAl = 2 cFe --- DTAl = DTFe = DT --- QAl = QFe --- mAl cAlDT = mFe cFe DT --- mAl 2 cFe = mFe cFe --- mAl = 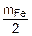 --- Letra D.
--- Letra D.
17) (PUC-SP-09) Ana, em sua casa de praia, deseja ferver 2 litros de água numa chaleira de alumínio de 500 g, ambos na temperatura

ambiente de 25°C. No entanto, seu botijão de gás natural possui apenas 1% da sua capacidade total.
Considerando a perda de calor para o meio ambiente de 35%, a quantidade de gás disponível é:
- Considere: Densidade da água = 1 g/cm3 Calor específico da água = 1,0 cal/g°C
- Calor específico do alumínio = 0,2 cal/g°C Capacidade total do botijão = 13 kg ou 31 litros
- Calor de combustão do gás natural = 12.000 kcal/kg
a) Suficiente, afinal ela necessita de aproximadamente 10 gramas.
b) Suficiente, afinal ela necessita de aproximadamente 20 gramas.
c) Suficiente, afinal ela necessita de aproximadamente 30 gramas.
d) Insuficiente, já que ela precisa de 200 gramas.
e) Insuficiente, já que ela precisa de 300 gramas.
Solução:

18) (UERJ-RJ-09) Um adulto, ao respirar durante um minuto, inspira, em média, 8,0 litros de ar a 20 °C, expelindo-os a 37 °C.

Admita que o calor específico e a densidade do ar sejam, respectivamente, iguais a 0,24 cal . g-1. °C¢ e 1,2 g . L-1.
Nessas condições, a energia mínima, em quilocalorias, gasta pelo organismo apenas no aquecimento do ar, durante 24 horas, é aproximadamente igual a:
a) 15,4 b) 35,6 c)56,4 d) 75,5
Solução:
d=m/v --- 1,2=m/8 --- m=9,5g --- Q=m.c.Δt=9,6.0,24.(37-20) --- Q=39,68 cal em 1 minuto --- em 24h --- Q=24x60x39,68 --- Q=56.401,92 cal --- Letra C
19) (UNICAMP-SP) As temperaturas nas grandes cidades são mais altas do que nas regiões vizinhas não povoadas, formando "ilhas urbanas de calor". Uma das causas desse efeito é o calor absorvido pelas superfícies escuras, como as ruas asfaltadas e as coberturas de prédios. A substituição de materiais escuros por materiais alternativos claros reduziria esse efeito. A figura mostra a temperatura do pavimento de dois estacionamentos, um recoberto com asfalto e o outro com um material alternativo, ao longo de

um dia ensolarado.
a) Qual curva corresponde ao asfalto?
b) Qual é a diferença máxima de temperatura entre os dois pavimentos durante o período apresentado?
c) O asfalto aumenta de temperatura entre 8h00 e 13h00. Em um pavimento asfaltado de 10.000 m2 e com uma espessura de 0,1 m, qual a quantidade de calor necessária para aquecer o asfalto nesse período? Despreze as perdas de calor. A densidade do asfalto é 2.300 kg/m3 e seu calor específico c = 0,75kJ/kg°C.
Solução:
a) O asfalto, por ser mais escuro recebe mais calor --- R- A
b) Observe no gráfico --- Δθmáx=56 – 46 --- Δθmáx=10oC
c) cálculo da massa de asfalto --- d=m/v --- 2,3.103=m/(0,1.10.000) --- m=2,3.103.103 --- m=2,3.106 kg --- Q=m.c.Δθ - - Q=2,3.106.0,75.103.(58– 30) --- Q=48,3.109J=4,83.107kJ
20) (PUC-MG) Dois corpos X e Y recebem a mesma quantidade de calor a cada minuto. Em 5 minutos, a temperatura do corpo X aumenta 30°C, e a temperatura do corpo Y aumenta 60°C. Considerando-se que não houve mudança de fase, é correto afirmar:
a) A massa de Y é o dobro da massa de X.
b) A capacidade térmica de X é o dobro da capacidade térmica de Y.
c) O calor específico de X é o dobro do calor específico de Y.
d) A massa de Y é a metade da massa de X.
Solução:
CX=Q/ΔθX --- Q=CX.ΔθX --- Q=30CX --- CY=Q/ΔθY --- Q=CY.ΔθY --- Q=60CY --- 30CX=60CY --- CX=2CY --- Letra B
21) (MACKENZIE-SP) Uma fonte térmica fornece 55 cal/s com potência constante. Um corpo de massa 100 g absorve totalmente a energia proveniente da fonte e tem temperatura variando em função do tempo, conforme o gráfico abaixo.
A capacidade térmica desse corpo e o calor específico da substância de que é constituído são, respectivamente, iguais a:

a) 2,2 cal/°C e 0,022 cal/g °C. b) 2,2 cal/°C e 0,22 cal /g °C. c) 2,2 cal/°C e 2,2 cal/g °C.
d) 22 cal /°C e 0,22 cal/g °C. e) 22 cal/°C e 0,022 cal/g °C.
d) 22 cal /°C e 0,22 cal/g °C. e) 22 cal/°C e 0,022 cal/g °C.
Solução:
capacidade térmica --- C=Q/Δθ=10.55/(45 – 20) --- C=22 cal/ºC --- calor específico --- C=m.c --- 22=100.c ---
22) (PUCCAMP-SP) Admita que o corpo humano transfira calor para o meio ambiente na razão de 2,0 kcal/min. Se esse calor pudesse ser aproveitado para aquecer água de 20 °C até 100 °C, a quantidade de calor transferida em 1 hora aqueceria uma quantidade de água, em kg, igual a:
Dado: calor específico da água = 1,0 kcal/kg °C
a) 1,2. b) 1,5. c) 1,8. d) 2,0. e) 2,5.
Solução:
1 minuto – 2 kcal --- 60min – Q --- Q=60.2 --- Q=120 kcal --- Q=m.c.Δt --- 120=m.1.80 --- m=1,5 kg --- Letra B
23) (UFSCAR-SP) A quantidade de calor que se deve fornecer a 1kg de uma substância para elevar sua temperatura de 5ºC é igual a 3,000cal. Qual o calor específico da substância no intervalo de temperatura considerado?
Solução:
Q=m.c.Δθ --- 3.000=1.000.c.5 --- c=3/5 --- c=0,6cal/gºC
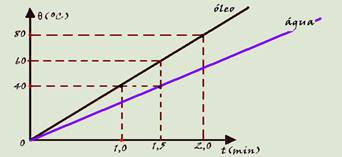
(FUVEST-SP) O esquema refere às questões 24 e 25.
Para aquecer 500g de água e 500g de óleo, utilizam-se dois recipientes iguais e de massa desprezível colocados simultaneamente (em t=0) sobre bicos de Bunsen iguais. As temperaturas são medidas para os dois líquidos , obtendo o gráfico abaixo (calor específico da água igual a 1,0 cal/goC).

24) (FUVEST-SP)
a) Quais as temperaturas da água e do óleo no instante t=1,5 minutos?
b) Qual dos líquidos tem maior calor específico? Justifique.
Solução:
a) água=40ºC --- óleo=60ºC
b) água --- no mesmo tempo de aquecimento, mesmo Q, (t=1,5min) sofre menor variação de temperatura (40ºC) contra o óleo (60ºC).
25) (FUVEST-SP)
a) Qual a razão entre os calores específicos da água e do óleo?
b) Qual o calor específico do óleo?
Solução:
a) cágua=Q/m(40 – 0) --- cóleo=Q/m(60 – 0) --- cágua/cóleo=Q/40m x 60m/Q=3/2 --- cágua/cóleo=3/2
b) cágua/cóleo=3/2 --- 1/cóleo=3/2 --- cóleo=2/3 cal/gºC
26) (UNESP-SP-2012) Clarice colocou em uma xícara 50 mL de café a 80 °C, 100 mL de leite a 50 °C e, para cuidar de sua forma física, adoçou com 2 mL de adoçante líquido a 20 °C. Sabe-se que o calor específico do café vale 1 cal/(g.°C), do leite vale 0,9 cal/(g.°C), do adoçante vale 2 cal/(g.°C) e que a capacidade térmica da xícara é desprezível.
Considerando que as densidades do leite, do café e do adoçante sejam iguais e que a perda de calor para a atmosfera é desprezível, depois de atingido o equilíbrio térmico, a temperatura final da bebida de Clarice, em °C, estava entre
(A) 75,0 e 85,0. (B) 65,0 e 74,9. (C) 55,0 e 64,9. (D) 45,0 e 54,9. (E) 35,0 e 44,9
Solução:
Ocorre trocas de calor apenas entre o leite, o café e o adoçante, pois a capacidade térmica da xícara, segundo o enunciado, é desprezível --- sendo as densidades as mesmas d=m/V --- m=d.V --- sendo t a temperatura final da mistura e d a densidade de cada elemento que participa das trocas de calor --- não havendo perda de calor para o ambiente, a soma das quantidades de calor trocadas é nula --- Qleite + Qcafé + Qadoçante = 0 --- mleite.cleite.(t – to) + mcafé.ccafé.(t – to) + madoçante.cadoçante.(t – to) = 0 --- d.Vleite.cleite.(t – to) + d.Vcafé.ccafé.(t – to) + d.Vadoçante.cadoçante.(t – to) = 0 --- as densidades se cancelam e as unidades mL também podem ser mantidas, pois também se cancelam --- 100.0,9.(t – 50) + 50.1.(t – 80) + 2.2.(t – 20) = 0 --- 90t – 4 500 + 50t – 4 000 + 4t – 80 = 0 --- 144t = 8 580 --- t = 59,58oC --- Letra C
27) (UNESP-SP-011) Foi realizada uma experiência em que se utilizava uma lâmpada de incandescência para, ao mesmo tempo, aquecer 100 g de água e 100 g de areia. Sabe-se que, aproximadamente, 1 cal = 4 J e que o calor específico da água é de 1 cal/gºC e o da areia é 0,2 cal/gºC. Durante 1 hora, a água e a areia receberam a mesma quantidade de energia da lâmpada, 3,6 kJ, e verificou-se que a água variou sua temperatura em 8ºC e a areia em 30ºC. Podemos afirmar que a água e a areia, durante essa hora, perderam, respectivamente, a quantidade de energia para o meio, em kJ, igual a
a) 0,4 e 3,0. b) 2,4 e 3,6. c) 0,4 e 1,2. d) 1,2 e 0,4. e) 3,6 e 2,4.
Solução:

28) (UFRJ-RJ-010) Um calorímetro ideal contém uma certa massa de um líquido A a 300K de temperatura. Um outro calorímetro, idêntico ao primeiro, contém a mesma massa de um líquido B à mesma temperatura.
Duas esferas metálicas idênticas, ambas a 400K de temperatura, são introduzidas nos calorímetros, uma no líquido A, outra no líquido B.

Atingido o equilíbrio térmico em ambos os calorímetros, observa-se que a temperatura do líquido A aumentou para 360K e a do líquido B, para 320K.
Sabendo que as trocas de calor ocorrem a pressão constante, calcule a razão cA/cB entre o calor específico cA do líquido A e o calor específico cB do líquido B.
Solução:

29) (UFC-CE-2009) X recipientes, n1, n2, n3 ..., nx , contêm, respectivamente, massas m a uma temperatura T, m/2 a uma temperatura T/2, m/4 a uma temperatura T/4 ..., m/2x -1 a uma temperatura T/2x -1, de um mesmo líquido. Os líquidos dos X recipientes são misturados, sem que haja perda de calor, atingindo uma temperatura final de equilíbrio Tf.
a) Determine Tf, em função do número de recipientes X.
b) Determine Tf, se o número de recipientes for infinito.
Solução:
a) A soma dos calores trocados deve ser igual a zero. --- Q1 + Q2 + ... + QN = 0 --- (m.c.DT)1 + (m.c.DT)2 + ... + (m.c.DT)N = 0 --- Como o líquido é o mesmo em todos os recipientes --- (m.DT)1 + (m.DT)2 + ... + (m.DT)N = 0 --- m.(Tf – T) + (m/2).(Tf – T/2) + ...+ (m/2N-1).(Tf – T/2N-1) = 0 --- Ssimplificadas as massas m --- (Tf – T) + (1/2).(Tf– T/2) + ...+ (1/2N-1).(Tf – T/2N-1) = 0 --- Tf – T + (1/2).Tf – T/22 + ...+ (1/2N-1)Tf – T/22N - 2 = 0 --- Tf.[1 + 1/2 + 1/4 +... + 1/2N-1] = T.[1 + 1/4 + 1/16 + ... + 1/22N – 2] = 0 --- aplicando a soma dos termos de uma PG 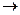 S = a1.(qN – 1)/(q – 1) --- Tf.2.(1 – 1/2N) = (4T/3).(1 – 1/4N) --- Tf.(1 – 1/2N) = (2T/3).(1 – 1/4N) --- Tf = (2T/3).(1 – 1/4N)/(1 – 1/2N)
S = a1.(qN – 1)/(q – 1) --- Tf.2.(1 – 1/2N) = (4T/3).(1 – 1/4N) --- Tf.(1 – 1/2N) = (2T/3).(1 – 1/4N) --- Tf = (2T/3).(1 – 1/4N)/(1 – 1/2N)
b) Para N tendendo a infinito --- Tf = (2T/3). (1 – 0)/(1 – 0) = 2T/3
30) (MACKENZIE-SP-09) Um calorímetro de capacidade térmica 6 cal/°C contém 80 g de água (calor específico = 1 cal/g°C) a 20°C. Ao se colocar um bloco metálico de capacidade térmica 60 cal/°C, a 100°C, no interior desse calorímetro, verificou-se que a temperatura final de equilíbrio térmico é 50°C. A quantidade de calor perdida para o ambiente, nesse processo, foi de:
a) 420 cal b) 370 cal c) 320 cal d) 270 cal e) 220 cal
Solução:
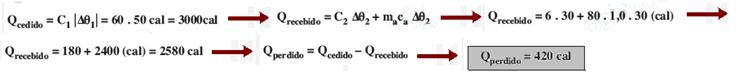
31) (UNESP-SP) Após assistir a uma aula sobre calorimetria, uma aluna conclui que, para emagrecer sem fazer muito esforço, bastaria tomar água gelada, já que isso obrigaria seu corpo a ceder calor para a água até que esta atingisse a temperatura de 36,5°C. Depois, esta água seria eliminada levando consigo toda essa energia e sem fornecer nenhuma energia para o corpo, já que água “não tem caloria”. Considerando que ela beba, num dia, 8 copos de 250 mL de água, a uma temperatura de 6,5°C, a quantidade de calor total que o corpo cederá à água para elevar a sua temperatura até 36,5°C equivale, aproximadamente, a energia fornecida por:
a) uma latinha de refrigerante light – 350 mL (2,5 kcal). b) uma caixinha de água de coco – 300 mL (60 kcal).
c) três biscoitos do tipo água e sal – 18g (75 kcal). d) uma garrafa de bebida isotônica – 473 mL (113 kcal).
e) um hambúrguer, uma porção de batata frita e um refrigerante de 300 mL (530 kcal).
(Considere o calor específico da água = 1 cal/g°C e sua densidade = 1 g/mL.)
Solução:
dágua=mágua/Vágua --- 1=mágua/8x250 --- mágua=2.000g (massa de água ingerida) --- quantidade de calor fornecida pelo organismo da menina para elevar a temperatura dessa massa de água de 6,5oC até 36,5oC --- Q=m.c.(t – to)=2.000.1.30 --- Q=60.000cal=60kcal --- Letra B
Inicialmente, ele coloca na banheira 100 litros de água fria a 20°C. Desprezando a capacidade térmica da banheira e a perda de calor da água, pergunta-se:
a) quantos litros de água quente, a 50°C, ele deve colocar na banheira?
b) se a vazão da torneira de água quente é de 0,20 litros/s, durante quanto tempo a torneira deverá ficar aberta?
Solução:
a) maf.c.(te –to) + maq.c.(te – to)=0 --- 100.c.(30 - 20) + maq.c.(30 - 50)=0 --- 100.c.(10) + maq.c.(-20)=0 --- maq=50L
b) 0,20L – 1s --- 50L – t s --- 0,2t=50 --- t=250s=4min e 10s
33) (FUVEST) Um ser humano adulto e saudável consome, em média, uma potência de 120J/s. Uma “caloria alimentar” (1kcal) corresponde, aproximadamente, a 4,0 x 103J. Para nos mantermos saudáveis, quantas “calorias alimentares” devemos utilizar, por dia, a partir dos alimentos que ingerimos?
a) 33 b) 120 c) 2,6x10³ d) 4,0 x10³ e) 4,8 x105
Solução:
P = Q / t , onde Q está em Joules (J) e t em segundos.
Se um ser humano consome 120 J em 1 segundo, quanto ele consumirá em
86400 segundos ( 1 dia).
120J -----------1s
X-----------86400s
Multiplicando cruzado, temos:
X = 120 . 86400
X = 10368000 J
Agora temos que passar isto para kcal, ou seja, outra regra de três:
1kcal----------------- 4,0 x 103J
Y-----------------------------10368000J
Y = 10368000 / 4,0 x 103J
Y = 2592 kcal
Colocando em notação científica:
Y = 2,6x 103 kcal. Letra C
34) (UFPR) Durante o eclipse, em uma das cidades na zona de totalidade, Criciúma-SC, ocorreu uma queda de temperatura de 8,0ºC. (Zero Horas – 04/11/1994) Sabendo que o calor específico sensível da água é 1,0 cal/gºC, a quantidade de calor liberada por 1000g de água, ao reduzir sua temperatura de
8,0ºC, em cal, é:
a) 8,0 b) 125 c) 4000 d) 8000 e) 64000
Solução:
Q = mc(T-T0)
A temperatura cai 8,0°C, ou seja, T - T0 = 8,0°C
Q = 1000.1.8
Q = 8000 cal
35) (UFSE) A tabela abaixo apresenta a massa m de cinco objetos de metal, com seus respectivos calores específicos sensíveis c.
METAL c(cal/gºC) m(g)
Alumínio 0,217 100
Ferro 0,113 200
Cobre 0,093 300
Prata 0,056 400
Chumbo 0,031 500
O objeto que tem maior capacidade térmica é o de:
a) alumínio b) ferro c) chumbo d) prata e) cobre
Solução:
Bem, a quantidade de calor é calculada da seguinte forma:
Q = mc(T-T0),
Porém o fator "mc" é conhecido como capacidade calorífica do corpo, uma vez que é medido a quantidade de calor, por variação de temperatura. Assim a equação fica: Q = C (T-T0), onde C (maiúsculo é a capacidade térmica).
Assim: C = mc, logo calculando a Capacidade térmica para todos os elementos
citados à cima, podemos distinguir aquele que tem a maior capacidade térmica:
Calumínio= 0,217 . 100 = 21,7 cal/°C
Cferro=0,113 . 200 = 22,6 cal/°C
CCobre= 0,093 . 300 = 27,9 cal/°C
CPrata= 0,056 . 400 = 22,4 cal/°C
Cchumbo = 0,031 . 500 = 15,5 cal/°C
Assim podemos ver que o maior valor de capacidade térmica é o Cobre, letra E.
36) Para aquecer 1 kg de uma substância de 10 0C a 60 0C, foram necessárias 400 cal.
Determine:
a) o calor específico do material
b) a capacidade térmica da substância
Solução:
São dados do exercício:m = 1kg = 1000 g
Q = + 400 cal
t0 = 10 0C
tf = 60 0C.
a)
A variação de temperatura da substância é dada por:
∆t = tf - t0
∆t = 60 – 10
∆t = 50 0C
Pela equação da quantidade de calor obtemos o calor específico da substância:
Q = m.c.∆t
400 = 1000 . c . 50
400 = 50 000 . c
400 / 50 000 = c
c = 0,008 (cal / g . 0C )
b)
A capacidade térmica é obtida pela equação C = m.c, logo:
C = m.c
C = 1000 . 0,008
C = 8 cal/0C
Respostas :
a) c = 0,008 (cal / g . 0C )
b) C = 8 cal/0C
37) Uma piscina com 40m2 contém água com profundidade de 1m. Se a potência absorvida da radiação solar, por unidade de área, for igual a 836W/m2 , o tempo de exposição necessário para aumentar a temperatura da água de 17oC a 19oC será, aproximadamente, de:"
Solução:
Calculando a quantidade de energia:

Calculando o tempo necessário para que ocorra a absorção de energia suficiente (supondo perda zero):
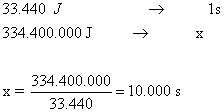
38) Um béquer, de massa desprezível, contém 500g de água á temperatura de 80ºC. Quantas gramas de gelo à temperatura de -40ºC devem ser adicionados à água para que a temperatura final da mistura seja de 50ºC?
Dados:
calor especifico da água: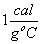 ;
;
calor especifico do gelo: ;
;
calor latente de solidificação da água: 80cal/g
calor especifico da água:
calor especifico do gelo:
calor latente de solidificação da água: 80cal/g
Solução:
Chamando de “1” a “água líquida” que estava no recipiente e de “2” ao gelo.
Energia que será fornecida pela substância “1” para substância “2”:
Energia que será fornecida pela substância “1” para substância “2”:
Essas 15.000cal serão fornecidas a substância 2, da seguinte forma:
1) uma parte para elevar a temperatura dela de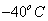 até
até 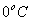 , que chamaremos de
, que chamaremos de 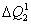 , que pode ser calculada da seguinte forma:
, que pode ser calculada da seguinte forma:
1) uma parte para elevar a temperatura dela de

2) uma parte para a mudança de estado físico da substância 2, que chamaremos de 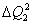 , ao atingir o
, ao atingir o 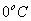 , que pode ser calculada da seguinte forma:
, que pode ser calculada da seguinte forma:
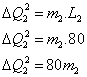
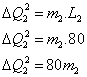
3) uma parte para elevar a temperatura da substância 2, de 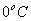 até
até 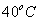 , que chamaremos de
, que chamaremos de 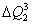 , que pode ser calculada da seguinte forma:
, que pode ser calculada da seguinte forma:
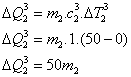
Sabemos que toda a energia cedida pela substância 1, 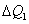 , será recebida pela substância 2,
, será recebida pela substância 2, 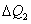 , mas
, mas
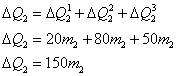
Logo
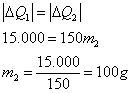
39) Um forno elétrico fornece 40kcal a um recipiente de alumínio com massa de 1,4kg e contendo 2,5 kg de álcool etílico. Sabendo-se que a temperatura inicial do recipiente é de 16ºC qual será a temperatura final, supondo que 25% do calor fornecido pelo forno seja disperso?
Dados: calor específico do alumínio = 0,21 cal/gºC;
calor específico do álcool = 0,58 cal/gºC.
calor específico do álcool = 0,58 cal/gºC.
Solução:
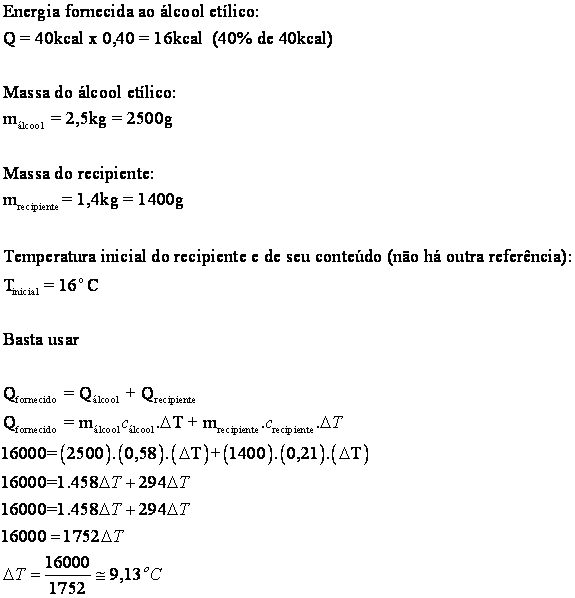
Dados:
calor especifico da água = 1cal/gºC
calor latente de fusão de gelo = 80 cal/g
Solução:
É um teste bastante simples, envolvendo troca de calor entre corpos.
Quem receberá calor será o GELO, que precisa para derreter totalmente:
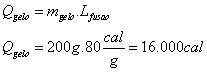
Quem fornecerá calor será o conjunto RECIPIENTE + ÁGUA.
Calculando a quantidade de energia MAXIMA que poderá ser fornecida antes de atingir a temperatura mais baixa possível 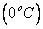 :
:
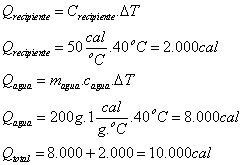
Como a energia MÁXIMA que o sistema pode perder ao gelo é de 10.000 cal e são necessárias 16.000 cal para fundir totalmente o gelo, conclui-se que o equilíbrio térmico 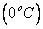 ocorrerá sem que todo gelo derreta.
ocorrerá sem que todo gelo derreta.
41) O calor de combustão é a quantidade de calor liberada na queima de uma unidade de massa de combustível. O calor de combustão do gás de cozinha é aproximadamente 6000kcal/kg, aproximadamente quantos litros de água à temperatura de 20ºC podem ser aquecidos até a temperatura de 100ºC com um bujão de gás de 13 kg? Despreze a perda de calor.
Solução:
Primeiramente calculemos qual a quantidade de energia que pode ser liberada pelos 13 kg de GLP. Usemos uma regra de três:
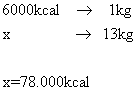
Sabendo qual a energia liberada (cálculo feito acima), podemos determinar qual a massa de água que pode ser aquecida:
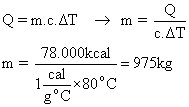
Sabendo-se a massa de água, pode-se determinar o volume, pois:
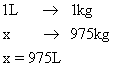
42) Um aluno simplesmente sentado numa sala de aula dissipa uma quantidade de energia equivalente a de uma lâmpada de 100W. O valor energético da gordura é 9,0kcal/g. Para simplificar adote 1cal =4 J
a) qual o mínimo de quilocalorias que o aluno deve ingerir por dia para repor a energia dissipada?
b) quantos gramas de gordura um aluno queima durante uma hora?
b) quantos gramas de gordura um aluno queima durante uma hora?
Solução:
O consumo de energia é de:
O número de segundos em um dia é de:
Logo, o consumo energético em um dia será:
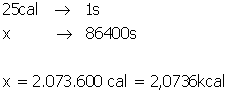
O consumo de energia em uma hora será de:
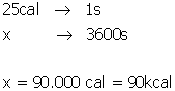
o que implica, se essa energia vier de queima de gordura, num consumo de gordura de:

43) Num recipiente de capacidade térmica 30 cal/ºC há 20 g de um líquido de calor específico 0,5 cal/ºC, a 60 ºC . Colocando-se nesse líquido 10 g de gelo em fusão, qual a temperatura final de equilíbrio, admitindo que o sistema está termicamente isolado do ambiente?
Solução: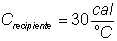
Para fundir totalmente o gelo são necessários:
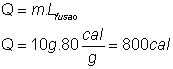
Energia máxima que pode ser fornecida pelo conjunto RECIPIENTE + LÍQUIDO:
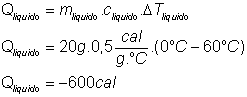
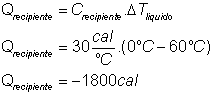
Como o gelo necessita para se fundir totalmente “apenas” 800 cal e temos a disposição um máximo de 600cal+1800cal=2400cal , concluímos que o gelo derreterá totalmente e a água proveniente do derretimento irá aquecer-se até a temperatura de equilíbrio do sistema (recipiente + liquido + água proveniente do gelo derretido):
Como o sistema está isolado:

44) Um rapaz deseja tomar banho de banheira com água a temperatura de 30oCmisturando água quente com água fria. Inicialmente ele coloca na banheira 100L de água fria a 20oC. Desprezando a capacidade térmica da banheira e a perda de calor de água pergunta-se
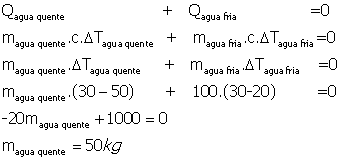
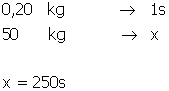
a) 500 b) 600 c) 700 d) 800 e) 900
a) quantos litros de água quente a 50oC ele deve colocar na banheira
b) se a vazão da torneira de água quente é 0,20L/s durante quanto tempo a torneira devera ficar aberta?
b) se a vazão da torneira de água quente é 0,20L/s durante quanto tempo a torneira devera ficar aberta?
Solução:
Usando o principio da conservação da energia e lembrando que a massa específica da água é de  :
:
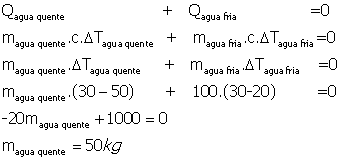
V=50L
A vazão de água quente é de 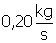 , logo:
, logo:
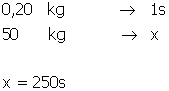
45) (Mackenzie) Uma fonte calorífica fornece calor continuamente, a razão de 150 cal/s, a uma determinada massa de água. Se a temperatura da água aumenta de 20°C para 60ºC em 4 minutos, sendo o calor específico sensível da água 1,0 cal/g°C, pode-se concluir que a massa de água aquecida, em gramas é:
Solução:
Dados: 150 J/s
V de temp. 60 - 40 = 20°C
Tempo: 4 min = 240s
150 x 240 = 36000cal
Tempo: 4 min = 240s
150 x 240 = 36000cal
Q = m.c.^t
36000 = m.1.40
40m = 36000
m = 900g
Letra e
36000 = m.1.40
40m = 36000
m = 900g
Letra e
46) Um suco de laranja foi preparado em uma jarra, adicionando-se a 250 mL de suco de laranja a 20°C, 50 g de gelo fundente. Estabelecido o equilíbrio térmico, a temperatura do suco gelado
era, em °C, aproximadamente, Dados:
1 × 10³ g/l, significa 1000g / litro = 1000g / 1000ml ou seja:
1000ml = 1000g => 250 ml = 250g)
No equilíbrio térmico:
ΣQ = 0
mcΔT (suco) + mcΔT(água proveniente do gelo) + m.L = 0
250.1.(Tf – 20) + 50.1.(Tf - 0) + 50.80 = 0
250Tf – 5000 + 50Tf + 4000 = 0
300Tf – 1000 = 0
300Tf = 1000
Tf = 1000/ 300
Tf = 3,3 <==
era, em °C, aproximadamente, Dados:
- calor específico da água = 1 cal/g°C
- calor específico do suco de laranja = 1 cal/g°C
- densidade do suco de laranja = 1 × 103 g/L
- calor latente de fusão do gelo = 80 cal/g
1 × 10³ g/l, significa 1000g / litro = 1000g / 1000ml ou seja:
1000ml = 1000g => 250 ml = 250g)
No equilíbrio térmico:
ΣQ = 0
mcΔT (suco) + mcΔT(água proveniente do gelo) + m.L = 0
250.1.(Tf – 20) + 50.1.(Tf - 0) + 50.80 = 0
250Tf – 5000 + 50Tf + 4000 = 0
300Tf – 1000 = 0
300Tf = 1000
Tf = 1000/ 300
Tf = 3,3 <==
47) Um bloco de gelo com 725 g de massa é colocado num calorímetro contendo 2,50 kg de água a uma temperatura de 5,0° C, verificando-se um aumento de 64 g na massa desse bloco, uma vez alcançado o equilíbrio térmico. Considere o calor específico da água (c = 1,0 cal/g ° C) o dobro do calor específico do gelo, e o calor latente de fusão do gelo de 80 cal/g. Desconsiderando a capacidade térmica do calorímetro e a troca de calor com o exterior, assinale a temperatura inicial do gelo.
a) -191,4ºC b) -48,6ºC c) -34,5ºC d) -24,3ºC e) -14,1ºC
Vamos colocar como mG = 725g, a massa de gelo, mA = 250g a massa da água. Temos que:
QG + Qfusão + QA = 0
725 . 0,5 (t0 - 0) - 64 . 80 + 2500 . 1 . (0 - 5) = 0
-725 . 0,5t0 = 5 . 2500 + 64 . 80 = 0
T0 = -48,6ºC
A temperatura inicial do gelo é t0 = -48,6ºC
a) -191,4ºC b) -48,6ºC c) -34,5ºC d) -24,3ºC e) -14,1ºC
Vamos colocar como mG = 725g, a massa de gelo, mA = 250g a massa da água. Temos que:
QG + Qfusão + QA = 0
725 . 0,5 (t0 - 0) - 64 . 80 + 2500 . 1 . (0 - 5) = 0
-725 . 0,5t0 = 5 . 2500 + 64 . 80 = 0
T0 = -48,6ºC
A temperatura inicial do gelo é t0 = -48,6ºC
48) Um calorímetro contém 200ml de água e o conjunto está a uma temperatura de 20ºC. Ao juntar ao calorímetro 125g de uma liga a 130ºC , verificamos que, após o equilíbrio térmico temperatura final é de 30ºC. Qual é a capacidade térmica do calorímetro?
Solução:Primeiro vamos calcular quanto 200 ml de água tem de massa. Vamos converter metros cúbicos para litros para por fim mililitros.
1000 kg/m³ = 1000 kg/1000 dm³ = 1 kg/ dm³ = 1 kg/ l
1000 kg/m³ = 1 000 g / 1000 ml
portanto
1000 kg/m³ = 1 g / ml
Assim:
ρ(densidade) = m / V
1g / ml = m / 200 ml
============
mágua = 200g
============
A energia (térmica) se conserva em um sistema isolado pois não há perdas para o ambiente. Então
Qliga + Qágua + Qcalorímetro = 0
aonde Q representa o calor trocado por cada um.
mas
Q = m c ΔT.
então
Qliga + Qágua + Qcalorímetro = 0
se torna
mliga cliga ΔT + mágua cágua ΔT + mcalorímetro ccalorímetro ΔT = 0
mliga cliga ΔT + mágua cágua ΔT + mcalorímetro ccalorímetro ΔT = 0
Usando mágua = 200g que calculamos acima e os demais dados do enunciado:
125 * 0,2 * (30-130) + 200 * 1 * (30-20) + mcalorímetro ccalorímetro * (30-20) = 0
mas CT (capacidade térmica) = m * c.
Então
125 * 0,2 * (30-130) + 200 * 1 * (30-20) + CT * (30-20) = 0
25 * (30-130) + 200* (30-20) + CT * (30-20) = 0
25 * (-100) + 200* (10) + CT * (10) = 0
-2500 + 2000 = - 10 CT
-500 = - 10 CT
Portanto
CT = 50 cal/ °C
Solução:Primeiro vamos calcular quanto 200 ml de água tem de massa. Vamos converter metros cúbicos para litros para por fim mililitros.
1000 kg/m³ = 1000 kg/1000 dm³ = 1 kg/ dm³ = 1 kg/ l
1000 kg/m³ = 1 000 g / 1000 ml
portanto
1000 kg/m³ = 1 g / ml
Assim:
ρ(densidade) = m / V
1g / ml = m / 200 ml
============
mágua = 200g
============
A energia (térmica) se conserva em um sistema isolado pois não há perdas para o ambiente. Então
Qliga + Qágua + Qcalorímetro = 0
aonde Q representa o calor trocado por cada um.
mas
Q = m c ΔT.
então
Qliga + Qágua + Qcalorímetro = 0
se torna
mliga cliga ΔT + mágua cágua ΔT + mcalorímetro ccalorímetro ΔT = 0
mliga cliga ΔT + mágua cágua ΔT + mcalorímetro ccalorímetro ΔT = 0
Usando mágua = 200g que calculamos acima e os demais dados do enunciado:
125 * 0,2 * (30-130) + 200 * 1 * (30-20) + mcalorímetro ccalorímetro * (30-20) = 0
mas CT (capacidade térmica) = m * c.
Então
125 * 0,2 * (30-130) + 200 * 1 * (30-20) + CT * (30-20) = 0
25 * (30-130) + 200* (30-20) + CT * (30-20) = 0
25 * (-100) + 200* (10) + CT * (10) = 0
-2500 + 2000 = - 10 CT
-500 = - 10 CT
Portanto
CT = 50 cal/ °C
49) (FMU) A temperatura durante a mudança de estado, para uma dada substância,
mág · cág · (Tf – Tiag) + mHg · cHg · (Tf – TiHg)+ mx· cx · (Tf – Tix) = 0,
52) Colocam-se 80 g de gelo a 0 °C em 100 g de água a 20 °C. Admitindo-se que não ocorreu troca de calor com o meio externo e sabendo-se que o calor latente de fusão do gelo é 80 cal/g e o calor específico da água é 1 cal/g · °C, determine (a) qual a temperatura final da mistura? (b) qual a massa de água líquida após atingido o equilíbrio térmico?

Fontes: http://www.sofisica.com.br/
a) é sempre maior que zero
b) é sempre menor que zero
c) varia conforme o estado de agregação da substância
d) é sempre constante à mesma pressão
e) varia independentemente do estado de agregação da substância
Letra D
50) Em um recipiente adiabático (que não troca calor com o meio exterior), juntamos 2000g de água a 22 ºC, 400g de mercúrio a 60 ºC e uma massa m de certa substancia x a 42ºC. Determine o valor da massa, sabendo-se que a temperatura final de equilíbrio térmico é 24 ºC. (dado CHg 0,033 cal/gºC , Cx= 0,113 cal/gºC).
Solução:
Observando a situação vemos que, pela temperatura de equilíbrio ser 42ºC, verificamos que a água recebeu calor, o mercúrio e a substancia x perderam calor. Pelo principio das trocas de calor:
Qágua + QHg +Qx = 0,
mág · cág · (Tf – Tiag) + mHg · cHg · (Tf – TiHg)+ mx· cx · (Tf – Tix) = 0,
2000 . 1 . (24 - 22) + 400 . 0,033 . (24 - 60) + m . 0,113 . (24 – 42) = 0,
Resolvendo,
m = 1472 g.
51) Uma vasilha adiabática contem 100g de água a 20ºC, misturando 250g de ferro a 80ºC, a temperatura atinge 33ºC. Determine o calor especifico do ferro. (Dado: calor especifico da água 1cal/gºC)
Solução:
Qágua + QFe = 0,
mág · cág · (Tf - Tiag) + mFe · cFe · (Tf - TiFe) = 0,
100. 1. ( 33 – 20) + 250 . cFe . (33 – 80) = 0,
100. 1. ( 33 – 20) + 250 . cFe . (33 – 80) = 0,
100 . 1. 13 + 250 . cFe . (-47) = 0,
1300 – 11750 cFe = 0,
1300 = 11750 . cFe
cFe = 0.11 cal/gºC.
52) Colocam-se 80 g de gelo a 0 °C em 100 g de água a 20 °C. Admitindo-se que não ocorreu troca de calor com o meio externo e sabendo-se que o calor latente de fusão do gelo é 80 cal/g e o calor específico da água é 1 cal/g · °C, determine (a) qual a temperatura final da mistura? (b) qual a massa de água líquida após atingido o equilíbrio térmico?
Solução:
a) A água líquida a 20 °C para resfriar-se até 0 °C deve perder uma quantidade de calor sensível calculada por:
Q = m · c ·
Q = 100 · 1 · (– 20)
Q = – 2 000 cal
Q = – 2 000 cal
O gelo, para se transformar completamente em água líquida, necessita receber uma quantidade de calor calculada por: Q = m · Lf
Portanto: Q = 80 · 80
Q = 6 400 cal
Q = 6 400 cal
Como a energia liberada pela água não é suficiente para derreter completamente o gelo, teremos no final, em equilíbrio térmico, uma mistura de gelo e água a 0 °C.
b) Calculando as quantidades de calor trocadas:
b) Calculando as quantidades de calor trocadas:
• fusão do gelo: Qf = m · 80
• resfriamento da água: Qs = – 2 000 cal
Como Qf + Qs = 0, temos:
m · 80 + (– 2 000) = 0
80 · m = 2 000
m =25 g
• resfriamento da água: Qs = – 2 000 cal
Como Qf + Qs = 0, temos:
m · 80 + (– 2 000) = 0
80 · m = 2 000
m =
Como é pedida a massa total de água líquida, devemos somar as massas de água provenientes da fusão e a já existente na mistura.
mT = 100 + 25 =125 g.
53) (UNICAMP) Em um dia quente, um atleta corre dissipando 750 W durante 30 min. Suponha que ele só transfira esta energia para o meio externo através da evaporação do suor e que todo seu suor seja aproveitado para sua refrigeração. Adote L = 2500 J/g para o calor latente de evaporação da água na temperatura ambiente.
a) Qual é a taxa de perde de água do atleta em kg/min?
b) Quantos litros de água ele perde nos 30 min de corrida?
Usar: densidade da água = 1,0 kg/l
b) Quantos litros de água ele perde nos 30 min de corrida?
Usar: densidade da água = 1,0 kg/l
Solução:
a) Q = mL (1) Q = P∆t (2) implica m/∆t = P/L implica m/∆t = (750J/s)/(2500000J/kg) implica
m/∆t = 3* 10-4 kg/s = 1,80* 10-2 kg/min
b) m/∆t = 1,8 *10-2 kg/min; m = 1,8 *10-2 kg/min* 30min; implica m = 0,54kgimplica
m = 0,54l
54) (Vunesp) Após assistir a uma aula sobre calorimetria, uma aluna concluiu que, para emagrecer sem fazer muito esforço, bastaria tomar água gelada, já que isso obrigaria seu corpo a ceder calor para a água até que atingisse a temperatura de 36,5 oC. Depois, essa água seria elinada levando com toda essa energia e sem fornecer nenhuma energia para o corpo, já que a água “não tem caloria”. Considere que ela beba, num dia, 8 copos de 250 ml de água, a uma temperatura 6,5 oC, a quantidade de calor total que o corpo cederá à água para elevar a sua temperatura até 36,5 oC equivale, aproximadamente,á energia fornecida por:
a) uma latinha de refrigerante light- 350 ml (2,5 kcal )
b) uma caixinha de água-de-coco – 300 ml (60 kcal)
c) três biscoitos do tipo água e sal – 18g (75 kcal)
d) uma garrafa de bebida isotônica – 473 ml (113 kcal)
e) um hambúrguer, uma porção batata frita e um refrigerante de 300 ml – (530 kcal)
(Considere o calor específico da água = 1 cal/g C e sua densidade = 1 g/ml.)
Solução:

Agora pratique
55) (PUC-RIO 2008) Quanto calor precisa ser dado a uma placa de vidro de 0,3 kg para aumentar sua temperatura em 80 °C? (Considere o calor específico do vidro como 70 J/kg °C)
A) 1060 J B) 1567 J C) 1680 J D) 1867 J E) 1976 J
56) (UFMG 2008) Depois de assar um bolo em um forno a gás, Zulmira observa que ela queima a mão ao tocar no tabuleiro, mas não a queima ao tocar no bolo. Considerando-se essa situação, é CORRETO afirmar que isso ocorre porque:
A) a capacidade térmica do tabuleiro é maior que a do bolo.
B) a transferência de calor entre o tabuleiro e a mão é mais rápida que entre o bolo e a mão.
C) o bolo esfria mais rapidamente que o tabuleiro, depois de os dois serem retirados do forno.
D) o tabuleiro retém mais calor que o bolo.
57) (PUC-RIO 2010) Uma quantidade de água líquida de massa m = 200 g, a uma temperatura de 30 Cº, é colocada em uma calorímetro junto a 150 g de gelo a 0 Cº. Após atingir o equilíbrio, dado que o calor específico da água é c = 1,0 cal/(g . Cº) e o calor latente de fusão do gelo é L = 80 cal/g, calcule a temperatura final da mistura gelo + água.
A) 10 Cº
B) 15 Cº
C) 0 Cº
D) 30 Cº
E) 60 Cº
58) (UFSM - RS) Um corpo de 400g e calor específico sensível de 0,20cal/g°C, a uma temperatura de 10°C, é colocado em contato térmico com outro corpo de 200g e calor específico sensível de 0,10cal/g°C, a uma temperatura de 60°C. A temperatura final, uma vez estabelecido o equilíbrio térmico entre os dois corpos, será de:
a) 14°C b) 15°C c) 20°C d) 30°C e) 40°C
59) (VEST - RIO - RJ) Um confeiteiro, preparando um certo tipo de massa, precisa de água a 40°C para obter melhor fermentação. Seu ajudante pegou água da torneira a 25°C e colocou-a para aquecer num recipiente graduado de capacidade térmica desprezível. Quando percebeu, a água fervia e atingia o nível 8 do recipiente. Para obter a água na temperatura de que precisa, deve acrescentar, no recipiente, água da torneira até o seguinte nível:
a) 18 b) 25 c) 32 d) 40 e) 56
60) (PUCCAMP) Uma barra de cobre de massa 200g é retirada do interior de um forno, onde estava em equilíbrio térmico, e colocada dentro de um recipiente de capacidade térmica 46cal/°C que contém 200g de água a 20°C. A temperatura final de equilíbrio é de 25°C. A temperatura do forno, em °C, é aproximadamente igual a: Dado: CCu = 0,03 cal/g°C
a) 140 b) 180 c) 230 d) 280 e) 300
Fontes: http://www.sofisica.com.br/


A capacidade térmica de um corpo sólido é C = 50 cal/ °C. Para que ele receba, no mínimo:
ResponderExcluira) 1600 cal
b) 2000 cal
c) 2500 cal
d) 3800 cal
e) 4000 cal
letra B
Excluirletra F
Excluir1) A massa de um determinado corpo líquido é 843 g cuja temperatura é 75 c, a massa de água é 324 g, cuja temperatura é 12°c, quando houve a misturq entre os dois a temperatura de equilibrio estava em 21°c. Qual é o valor do calor específico do líquido ?
ResponderExcluirMassa do líquido= 843g
ExcluirT0= 75 ºC
Massa da água= 324g
T0= 12ºC
c da água= 1cal/gºC
Temperatura final de ambos= 21ºC
c do líquido= ?
Ql + Qa= 0
843.c.(21-75) + 324.1. (21-12)= 0
-45522c + 2916= 0
c= -2916/ -45522
c= +0,064
um liquido inicialmente a 30oc recebeu 80kcal até atingir 60oc.sabendo que a massa do liquido é de 200g determine o seu cloror especifico
ResponderExcluirQ=m.c.(t-t°)
Excluir80=200.c.(60-30)
80=6000c
c=80/6000
c=0,013cal
um liquido inicialmente a 30oc recebeu 80kcal até atingir 60oc.sabendo que a massa do liquido é de 200g determine o seu cloror especifico
ResponderExcluirUm bloco de aluminio de 500g está na temperatura de 80ºC. Deteminar a massa de gelo a 0C que é preciso colocar em contato com o alumínio para se obter um sistema aluminio água. Dados: Calor específico do aluminio: 0,21 cal/g.C calor latente de fusão do gelo: 80 cal/g
ResponderExcluirPessoal No início da questão 40, na resolução, calculou-se a quantidade de calor que o gelo necessitou para derreter, neste caso não entendi como a massa de gelo deu 200g, no enunciado fala que é 50g, me expliquem por favor.
ResponderExcluirParceiro na resolução da questão 40 vc confudiu a massa do gelo com a da água. Vc colocou a massa do gelo como 200g, quando na verdade são apenas 50g. Com isso o calor cedido pelo recipiente e a água é o bastante pra derreter todo o gelo e ainda deixar a temperatura de equilíbrio em 20ºC. Abs
ResponderExcluirNa primeira questão:
ResponderExcluirb) o calculo ficaria assim> fala que a temperatura diminui 15 gr. Celsius, então 35 - 15 = 20, que é a temp. final!!!!
Qc= 500 . 0,4 . (20 - 35)
Qc= 3000cal
É para relaxar vou ouvir uma música no site www.ouvirradiosonline.com.br.
ResponderExcluirDetermine a máxima dose equivalente permissível por semana para um trabalhador
ResponderExcluircom radiação.
Num calorímetro ideal contendo 500g de água à temperatura de 10°C,é misturado um líquido à 45°C, de calor específico 0,75 cal/g.°C.Após 15 minutos, mede-se a temperatura de equilíbrio térmico e encontra-se o valor 25°C. Qual a massa do líquido colocado no calorímetro ?
ResponderExcluirO calor específico de uma substância é 0,5 cal/g °C.se a temperatura de 4g dessa substancia se eleva de 10°C,qual a quantidade de calor absorvida pela substância (alguém faz os cálculos pra mim por favor)
ResponderExcluirUm corpo metálico a 270 ºC é colocado em um recipiente adiabático que contém água a 50 ºC. Admitindo que as trocas de calor ocorrem apenas entre o corpo e a água, determine o calor específico do metal, sabendo que as massas de água e de metal são iguais e que a temperatura final de equilíbrio é de 70 ºC. [dado: cágua = 1,0 cal/(g . ºC)]
ResponderExcluirMistura-se, em uma caneca, um total de 300ml (300g) de café, a 90ºC , com 100 ml (100g) de leite, a 4ºC. Determine a temperatura de equilíbrio térmico.(0,5)Use calor específico do café = 1cal/gºC e do Leite = 2cal/gºC :
ResponderExcluir50,2
55,6
57
58,3
60
Um bloco de zinco de capacidade igual a 20 Cal/ºC recebe 100 Cal. A variação de temperatura do bloco será:
ResponderExcluir1 ponto
a) 5ºC
b) 6ºC
c) 10ºC
d)1ºC
e) -2ºC
Um corpo de massa igual a 4 kg é aquecido de 68°F a 373ºK durante 5 minutos. Sabendo-se que o calor específico desse corpo é igual a 0,5 cal/g°C. O Calor Sensível em Joules (J) e a Potência Térmica em J/s do corpo é: Considerar 1 cal = 4,0 Joules *
ResponderExcluir40000 J e 133 J/s
10000 J e 100 J/s
20000 J e 100 J/s
40000 J e 100 J/s
20000 J e 133 J/s