Geometria molecular
A geometria molecular explica como estão dispostos os átomos dentro da molécula.
Os átomos tendem a ficar numa posição mais espaçada, esparramada possível. Assim conseguem adquirir a estabilidade.
As geometrias moleculares são: linear, angular, trigonal planar, piramidal, tetraédrica, octaédrica, forma de T, bipirâmide trigonal, gangorra ou tetraédrica distorcida, quadrado planar, pirâmide de base quadrática.
Os átomos tendem a ficar numa posição mais espaçada, esparramada possível. Assim conseguem adquirir a estabilidade.
As geometrias moleculares são: linear, angular, trigonal planar, piramidal, tetraédrica, octaédrica, forma de T, bipirâmide trigonal, gangorra ou tetraédrica distorcida, quadrado planar, pirâmide de base quadrática.
Veja as principais geometrias moleculares:
Linear
Para moléculas diatômicas (com dois átomos).
Polar – átomos diferentes: HCl H – Cl
Apolar – átomos iguais: H2 H – H |
Para moléculas triatômicas (com três átomos), sem sobra de elétrons do elemento central. Apolares.
Formam um ângulo de 180°.
Formam um ângulo de 180°.
CS2 S – C – S
|
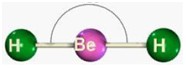
Angular
Para moléculas triatômicas com sobra de elétrons. Polares.
Formam um ângulo de 104,5º.
Formam um ângulo de 104,5º.
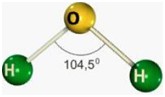
Trigonal Planar ou triangular
Para moléculas tetratômicas sem sobra de elétrons. Apolares.
Formam um ângulo de 120°.
Formam um ângulo de 120°.
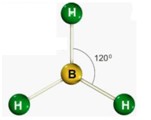
Piramidal
Para moléculas tetratômica, com sobra de um par de elétrons. Polares. Formam um ângulo de 107º.
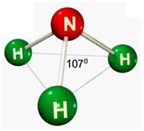

Tetraédrica
Para moléculas pentatômicas com átomo central. Apolares. Formam um ângulo de 109º 28
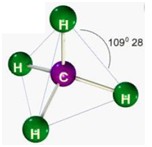
Bipiramidal
As quatro ligações se distribuirão no espaço de maneira a diminuir ao máximo a repulsão entre elas e a estrutura será um tetraedro com o átomo central ocupando o centro do sólido geométrico.
Resumindo as geometrias mais comuns obtidas (observando-se, principalmente, os pares eletrônicos não ligantes) são:

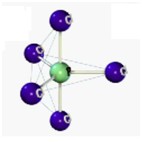
Bipiramidal
As quatro ligações se distribuirão no espaço de maneira a diminuir ao máximo a repulsão entre elas e a estrutura será um tetraedro com o átomo central ocupando o centro do sólido geométrico.

Resumindo as geometrias mais comuns obtidas (observando-se, principalmente, os pares eletrônicos não ligantes) são:
| Geometria | Pares eletrônicos totais | Pares eletrônicos não ligantes | Pares eletrônicos ligantes |
| Linear | 2 5 6 | 0 3 4 | 2 2 2 |
| Triangular | 3 | 0 | 3 |
| Angular | 3 4 | 1 2 | 2 2 |
| Tetraédrica | 4 | 0 | 4 |
| Piramidal | 4 | 1 | 3 |
| Bipiramidal | 5 | 0 | 5 |
| Octaédrica | 6 | 0 | 6 |
Obs.: toda molécula biatômica assume geometria linear. E, apenas as geometrias linear e triangular são planas: as outras são espaciais.
A teoria da repulsão dos pares eletrônicos de valência (TRPEV) aponta que os pares eletrônicos (elétrons de valência, ligantes ou não) do átomo central se comportam como nuvens eletrônicas que se repelem e, portanto, tendem a manter a maior distância possível entre si. Mas, como as forças de repulsão eletrônica não são suficientes para que a ligação entre os átomos seja desfeita, essa distância é verificada no ângulo formado entre eles.
Determinação do caráter de uma ligação
1. A diferença de eletronegatividade
O que determina o tipo de ligação que será estabelecida entre dois átomos é a diferença de eletronegatividadeUma ligação química pode ser 100% covalente quando não há nenhuma diferença de eletronegatividade entre os átomos, mas nunca será 100% iônica.
Desse modo, o mais correto é dizer que:Quando dois átomos estabelecem uma ligação química, dependendo da diferença de eletronegatividade existente entre eles, essa ligação terá um caráter mais acentuado para o covalente ou mais para o iônico.Se a diferença de eletronegatividade entre dois átomos for menor ou igual 1,6, a ligação entre ele será acentuada covalenteSe for maior que 1,6 será acentuada iônica.
2. Valência e NÓX
A Valência de um elemento químico é o número de ligações iônicas, covalentes, que um átomo desse elemento é capaz de estabelecer.
Ex o H e monovalente=> faz uma ligação
O bivalente=> faz duas ligações
N e Trivalente=> faz três ligações
NÓX
Chamamos de número de oxidação ou nóx a carga assumida por um átomo quando a ligação que o une a um outro é quebrada.
Existem três casos a serem analisados com relação ao nóx de um elemento: composto iônico, covalente e substância simples.
Num composto iônico, ou nox é a própria carga do íon, pois quando a ligação se rompe, já ocorreu a transferência do elétron do átomo menos para o mais eletronegativo.

Na formação do NaCl, o Na passa de 11 para 10 elétrons e o Cl passa de 17 para 18 elétrons. O Na fica com carência de 1 elétron e assume a carga 1+, o Cl fica com excesso de um elétrons e assume a carga 1-. Então, os nox do Na e do Cl, neste composto, serão respectivamente 1+ e 1-.
Num composto covalente assume-se que a mesma se quebra e que o par de elétrons fica com o átomo mais eletronegativo. Na molécula de HCl, o átomo mais eletronegativo é o Cl e o menos é o H. O Cl adiciona um elétron à sua eletrosfera, enquanto o H perde um. Então, os nox do Cl e do H serão, respectivamente, 1- e 1+.

Em uma substância simples, os nox de todos os átomos componentes é igual a zero, pois não é possível a existência de diferenças deeletronegatividade.
Exemplos: S8, H2, O2, P4, Cgraf, Cdiam.
Regras para a determinação do NOX
Metais alcalinos 1+Metais alcalino-terrosos 2+Oxigênio (menos nos peróxidos, em que é 1-) 2 -Hidrogênio (menos nos hidretos, em que é 1-) 1+Alumínio (Al) 3+Zinco (Zn) 2+Prata (Ag) 1+Substâncias simples 0
A soma dos números de oxidação num composto é igual a zero.
A soma dos números de oxidação num íon composto é igual a carga do íon.
Polaridade das moléculas
Par Para decidir se uma molécula é ou não polar, devemos observar 2 aspectos:
Diferença de eletronegatividadeGeometria molecular
Ligação covalente e polaridade
Ligação covalente apolar - Os átomos ligados têm igual eletronegatividade.
Ligação covalente polar - Os átomos ligados têm diferente eletronegatividade. A toda ligação covalente polar está associado um vetor polarização, orientado da carga positiva para negativa.
Polaridade das moléculas
Molécula apolar - A soma vetorial dos vetores polarização associados a todas as ligações covalentes polares da molécula é nula.
Molécula polar - A soma vetorial dos vetores polarização associados a todas as ligações covalentes polares na molécula é diferente de zero.
Polaridade e solubilidade
Polaridade e solubilidade: "O semelhante dissolve o semelhante."
Substância polar dissolve substância polar e não dissolve ou dissolve pouca quantidade de substância apolar.Substância apolar dissolve substância apolar e não dissolve ou dissolve pouca quantidade de substância polar.
Fonte: www.geocities.com www.soquimica.com.br
Exercícios sobre geometria molecular
As questões 01 a 05 serão respondidas pelas alternativas:
a) linear
b) angular
c) piramidal
1) Uma molécula do tipo
2) Uma molécula do tipo
3) Uma molécula do tipo
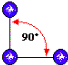 tem geometria:
tem geometria:4) Uma molécula do tipo
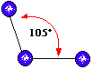 tem geometria:
tem geometria:5) Uma molécula do tipo
 tem geometria:
tem geometria:
6) (PUC-RJ) De acordo com a Teoria da repulsão dos pares eletrônicos da camada de valência, os pares de elétrons em torno de um átomo central se repelem e se orientam para o maior afastamento angular possível. Considere que os pares de elétrons em torno do átomo central podem ser uma ligação covalente (simples, dupla ou tripla) ou simplesmente um par de elétrons livres (sem ligação).
Com base nessa teoria, é correto afirmar que a geometria molecular do dióxido de carbono é:
a) trigonal plana.
b) piramidal.
c) angular.
d) linear.
e) tetraédrica.
7) (UEM – PR) Considerando a molécula de amônia, assinale a alternativa correta.
a) A geometria molecular corresponde a um tetraedro regular.
b) O átomo de nitrogênio e dois átomos de hidrogênio ocupam os vértices de um triângulo equilátero.
c) O centro da pirâmide formada pelos átomos de nitrogênio e pelos átomos de hidrogênio é ocupado pelo par de elétrons livres.
d) Os átomos de hidrogênio ocupam os vértices de um triângulo equilátero.
e) As arestas da pirâmide formada pelos átomos de nitrogênio e pelos átomos de hidrogênio correspondem a ligações iônicas.
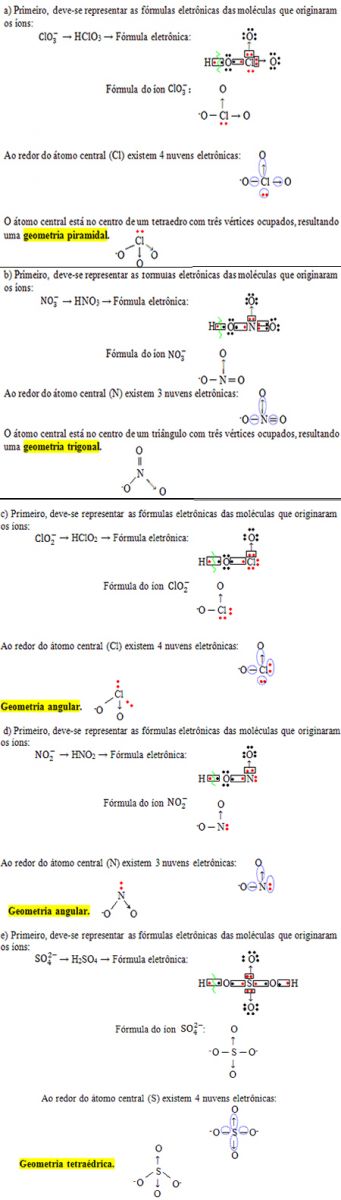
8) Determine a geometria molecular dos seguintes íons:
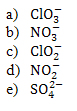
9) Desenhar esquematicamente a molécula NH2F, mostrando apenas os orbitais que participam das ligações. Qual a forma geométrica da molécula?
Números atômicos: N (7); H (1); F (9)
A análise de sua estrutura permite concluir que essa espécie química apresenta uma geometria
a) linear.
b) piramidal.
c) tetraédrica.
d) trigonal planar.
e) quadrado planar.
11) (UFMT) - A teoria da repulsão dos pares eletrônicos sustenta: ao redor do átomo central, pares eletrônicos ligantes e não ligantes se repelem, tendendo a ficar tão afastados quanto possível. De acordo com essa teoria, quais estruturas podem ser previstas para as moléculas de SF6, PCl5, CH4, respectivamente?
a) tetraédrica, bipirâmide trigonal e octaédrica.
b) octaédrica, bipirâmide trigonal e tetraédrica.
c) bipirâmide trigonal, tetraédrica e tetraédrica.
d) tetraédrica, tetraédrica e octaédrica.
e) octaédrica, tetraédrica e bipirâmide trigonal.
12) (UFV MG) - Em relação à geometria das moléculas de água, amônia, metano e etino, assinale a alternativa CORRETA:
a) H2O, angular; NH3, piramidal; CH4, tetraédrica; C2H2, quadrática plana.
b) H2O, angular; NH3, trigonal plana; CH4, quadrática plana; C2H2, linear.
c) H2O, linear; NH3, trigonal plana; CH4, tetraédrica; C2H2, linear.
d) H2O, angular; NH3, piramidal; CH4, tetraédrica; C2H2, linear.
e) H2O, linear; NH3, tetraédrica; CH4, quadrática plana; C2H2, trigonal plana.
13) (UFRN) - A emissão de substâncias químicas na atmosfera, em níveis elevados de concentração, pode causar danos ao ambiente. Dentre os poluentes primários, destacam-se os gases CO2, CO, SO2 e CH4. Esses gases, quando confinados, escapam lentamente, por qualquer orifício, por meio de um processo chamado efusão.
A molécula que apresenta geometria tetraédrica é
a) CO2
b) SO2
c) CO
d) CH4
e) HCl
14) (UFTM MG) - O Protocolo de Montreal completou 20 anos, e os progressos alcançados já podem ser notados. Segundo um ranking compilado pelas Nações Unidas, o Brasil é o quinto país que mais reduziu o consumo de CFCs (clorofluorcarbonos), substâncias que destroem a camada de ozônio (O3). O acordo para redução desses poluentes foi assinado em 1987 por 191 países, que se comprometeram em reduzir o uso do CFC em extintores de incêndios, aerossóis, refrigeradores de geladeiras e ar condicionado. Os CFCs podem ser compostos constituídos de um ou mais átomos de carbono ligados a átomos de cloro e/ou flúor.
A molécula de ozônio apresenta geometria molecular
a) angular.
b) linear.
c) piramidal.
d) tetraédrica.
e) trigonal plana.
15) (UNICID) - A desinfecção de águas residuárias de uso agrícola é um processo indispensável à proteção da saúde pública. O ozônio, O3, pode ser utilizado para esse fim, já que é bastante eficiente na destruição de organismos patogênicos. Sobre as propriedades do ozônio, pode-se afirmar que é constituído por moléculas com geometria
a) trigonal e é um isótopo do gás oxigênio.
b) trigonal e é um alótropo do gás oxigênio.
c) linear e é um alótropo do gás oxigênio.
d) angular e é um isótopo do gás oxigênio.
e) angular e é um alótropo do gás oxigênio.
Gabarito:
01. A 02. A 03. B 04. B 05. C
6. Letra “d”. Geometria linear: 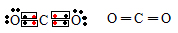 7. D
7. D
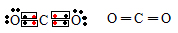 7. D
7. D
8.
10) D
11) B
12) D
13) D
14) A
15) E

Me ajudou muito,parabéns ótima explicação e ótimos exercícios!
ResponderExcluir