As moléculas se atraem. Deste fato simples, surgem importantes conseqüências. Rios, lagos e oceanos existem porque as moléculas se atraem e formam um líquido. Sem esse líquido não haveria vida. Sem as forças entre as moléculas, nossa carne se separaria dos ossos e os oceanos virariam gás. Dizendo de forma menos dramática, as forças entre as moléculas governam as propriedades físicas da matéria e contribuem para explicar as diferenças entre as substâncias que estão a nossa volta. Elas explicam por que o dióxido de carbono é um gás que exalamos, por que a madeira é um sólido sobre o qual podemos ficar em pé e por que o gelo flutua na água. Quando muito próximas, as moléculas também se repelem. Ao entrar em contato, resistem á compressão. É por isso que as moléculas têm volume definido e não podem ser esmagadas até volume zero. Quando moléculas átomos ou íons aproximam-se uns dos outros dos outros dois fenômenos podem ocorrer, eles podem reagir ou eles podem interagir. Uma reação química por definição requer que ligações químicas sejam quebradas e/ou formadas. Uma interação química significa que as moléculas se atraem ou se repelem entre si, sem que ocorra a quebra ou formação de novas ligações químicas. Estas interações são frequentemente chamadas de interações não covalentes ou interações intermoleculares. As energias envolvidas em tais tipos de interações são muito menores que aquelas envolvidas em processos reativos. As interações intermoleculares estão intimamente relacionadas com as propriedades termodinâmicas de líquidos, sólidos e gases. Logo, o entendimento de tais forças intermoleculares é de extrema relevância se quisermos entender o comportamento a sistemas químicos a nível molecular. Estas interações surgem devido às forças intermoleculares, que são essencialmente de natureza elétrica, e fazem com que uma molécula influencie o comportamento de outra molécula em suas proximidades. Estas forças são responsáveis pelo desvio do comportamento ideal dos gases, e são mais efetivas nas fases líquida e sólida da matéria. Uma vez que estas forças intermoleculares se originam do contato não reativo entre duas moléculas, é natural pensar que as forças intermoleculares tenham um comportamento que varie com o inverso da distância de separação entre as moléculas interagentes, isto é, as interações serão mais fortes para pequenas distâncias de separação entre as moléculas. Tal fato faz com que as interações intermoleculares possam ser agrupadas em interações de curto alcance (aquelas que atuam a pequenas distâncias de separação intermolecular) e interações de longo alcance, que atuam em grandes distâncias de separação intermolecular. As fases condensadas da matéria são uma consequência da ação das forças intermoleculares. Quando os átomos, íons e moléculas não têm energia suficiente para escapar da influência de seus vizinhos, eles formam sólidos com arranjos característicos. Os líquidos formam-se quando os átomos podem se mover, mas não escapam completamente de sua influência. Todos os processos vitais estão relacionados com o reconhecimento molecular específico inter e intramolecular. Estes processos podem ser definidos como sendo interações fracas, usualmente reversíveis e altamente seletivas entre duas moléculas (intermolecular) ou dentro da macromolécula biológica (intramolecular). A tabela ilustra como os propriedades de um sistema estão intimamente relacionadas com a sua composição e estrutura tridimensional. Nesta tabela, são mostrados compostos com massas moleculares aproximadamente iguais, mas, que à temperatura ambiente existem em diferentes fases: butano (gás), acetona e álcool isopropílico (líquidos). É interessante perceber que dos dois líquidos, acetona e álcool isopropílico, a única diferença entre eles é a substituição de um grupo C=O por um grupo C–OH. Esta mudança é suficiente para alterar completamente as características dos dois líquidos. Como pode ser visto a acetona é um líquido muito mais volátil que o álcool isopropílico. A substituição dos grupos funcionais é acompanhada de uma mudança na estrutura tridimensional da molécula, que irá afetar completamente na qual elas irão interagir no líquido. Também é mostrado nesta tabela, os diferentes tipos de interações moleculares

Tipos de Interações Intermoleculares
Existem três tipos de interações intermoleculares. Elas servem somente para as substâncias que possuem ligações covalentes. São elas:
- Pontes de Hidrogênio ou Ligações de Hidrogênio;
- Forças dipolo-dipolo, dipolo-permanente ou dipolar;
- Forças de London, Forças de Van der Waals ou dipolo-induzido.
Pontes de Hidrogênio ou ligações de hidrogênio
Esta interação intermolecular pode ser chamada também de Ligações de Hidrogênio. É realizada sempre entre o hidrogênio e um átomo mais eletronegativo, como flúor, oxigênio e nitrogênio.
Flúor
H + Oxigênio Nitrogênio |
É característico em moléculas polares. Podem ser encontrados no estado sólido e liquido.
É a ligação mais forte de todas, devida à alta eletropositividade do hidrogênio e à alta eletronegatividade do flúor, oxigênio e nitrogênio. De um lado, um átomo muito positivo e do outro, um átomo muito negativo. Isto faz com que a atração entre estes átomos seja muito forte. Por isso, em geral são sólidos ou líquidos.
É a ligação mais forte de todas, devida à alta eletropositividade do hidrogênio e à alta eletronegatividade do flúor, oxigênio e nitrogênio. De um lado, um átomo muito positivo e do outro, um átomo muito negativo. Isto faz com que a atração entre estes átomos seja muito forte. Por isso, em geral são sólidos ou líquidos.
Exemplos:
H2O, HF, NH3
H2O, HF, NH3
Uma conseqüência das pontes de hidrogênio que existem na água é a sua elevada tensão superficial. As moléculas que estão no interior do líquido atraem e são atraídas por todas as moléculas vizinhas, de tal modo que as essas forças se equilibram. Já as moléculas da superfície só são atraídas pelas moléculas de baixo e dos lados. Consequentemente, essas moléculas se atraem mais fortemente e criam uma película parecida com uma película elástica na superfície da água. Este fenômeno ocorre com todos os líquidos, mas com a água, acontece mais intensamente. A tensão superficial explica alguns fenômenos, como por exemplo, o fato de alguns insetos caminharem sobre a água e a forma esférica das gotas de água.
As ligações de hidrogênio também representam importante papel em moléculas de extrema importância para os seres vivos: elas determinam a forma das proteínas, e constituem a força que une as hélices do DNA.
Forças dipolo-dipolo
É a Força intermolecular presente em compostos polares.
- δ + δ- δ + δ- δ + δ-
H ? Br ------------------------- H ? Br --------------------- H ? Br
Repare que nas moléculas de ácido bromídrico (HBr) existem pólos δ + e δ-,são eles os responsáveis por esta molécula ser polar.
Exemplos de compostos polares em que ocorre interação dipolo-dipolo:
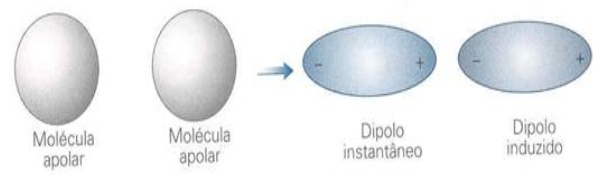
H2S, CO, SO2, HClForças de London - É quando as moléculas não contêm dipolos (são apolares), como é que elas podem se atrair? Pense numa molécula como uma entidade não estática, mas contendo elétrons em constante movimento; é razoável pensar que num determinado momento a distribuição nessa molécula pode não ser perfeitamente simétrica, e apareçam então pequenos dipolos instantâneos neste momento. Esses dipolos desaparecerão em muito pouco tempo, podendo levar a uma molécula neutra ou a outros dipolos, inclusive contrários; mas no curto espaço de tempo em que eles existem, eles podem induzir a formação de dipolos contrários na molécula vizinha, levando as duas a se atraírem mutuamente. Exemplo:
 Quadro-Resumo das propriedades físicas e os tipos de ligações:Tipo de substânciaMetálicaIônicaCovalente polarCovalente apolarPartículaÁtomos e cátionsÍonsmoléculasMoléculasAtração entre as partículasPor “elétrons livres”Atração eletrostáticaPontes de hidrogênio ou dipolo-dipoloVan der WaalsEstado físicoSólido (exceto Hg)SólidoLíquidoGasosoPF e PEAltoAltoBaixoMuito baixoCondutividade elétricaAlta (sólidos e líquidos), sem atração da substânciaAlta (fundidos ou em solução)Praticamente nula quando pura. Condutora quando em soluçãoNulaSolubilidade em solventes comuns
Quadro-Resumo das propriedades físicas e os tipos de ligações:Tipo de substânciaMetálicaIônicaCovalente polarCovalente apolarPartículaÁtomos e cátionsÍonsmoléculasMoléculasAtração entre as partículasPor “elétrons livres”Atração eletrostáticaPontes de hidrogênio ou dipolo-dipoloVan der WaalsEstado físicoSólido (exceto Hg)SólidoLíquidoGasosoPF e PEAltoAltoBaixoMuito baixoCondutividade elétricaAlta (sólidos e líquidos), sem atração da substânciaAlta (fundidos ou em solução)Praticamente nula quando pura. Condutora quando em soluçãoNulaSolubilidade em solventes comuns
InsolúvelSolúvel em solvente polarSolúvel em solvente polarSolúvel em solvente apolarDurezaDura, mas maleável e dúctilDura, porém quebradiça--Geralmente, usa-se a regra que semelhante dissolve semelhante. Isto quer dizer que solvente polar dissolve substância polar e que solvente apolar dissolve substância apolar. Mas nem sempre esta regra está correta. A água, por exemplo, é uma substância polar e pode dissolver o álcool etílico, que é apolar.
Veja qual força intermolecular é mais intensa através da figura abaixo:.jpg) A seta indica a ordem crescente da intensidade de interação.
A seta indica a ordem crescente da intensidade de interação.
Fontes: www.ebah.com.br
- www.soquimica.com.br
Os espaços acima são corretamente preenchidos pela alternativa:
a) covalente apolar - forças de Van der Waals
b) covalente apolar - atração dipolo induzido-dipolo induzido
c) covalente polar - ligações de hidrogênio
d) covalente polar - forças de Van der Waals
e) covalente polar - atração dipolo-dipolo.
2) A seguir temos quatro substâncias representadas por suas moléculas:
1. C2H6
2. H3C ─ CH2 ─ CH2 ─ OH
3. H2C ─ CH2 ─ CH2
│ │
OH OH
4. C3H8
│ │
OH OH
4. C3H8
No estado líquido, os tipos de forças intermoleculares que existem em cada uma dessas substâncias são, respectivamente:
a) dipolo induzido, ligação de hidrogênio, dipolo-dipolo, dipolo induzido
b) dipolo induzido, ligação de hidrogênio, ligação de hidrogênio, dipolo induzido
c) dipolo induzido, ligação de hidrogênio, dipolo induzido, dipolo-dipolo
d) ligação de hidrogênio, dipolo-dipolo, dipolo-dipolo, ligação de hidrogênio
e) todas são ligações de hidrogênio.
I. H2O(l) → H2O(g)
II. H2O(g) →H2(g) + O2(g)
Indique quais ligações são rompidas em cada um dos processos.
4) Sabendo-se que a temperatura de ebulição de uma substância depende da intensidade das forças intermoleculares presentes, assinale a alternativa que corretamente apresenta as substâncias em ordem crescente de temperatura de ebulição.
a) H2, N2, O2, Br2
b) N2, Br2, O2, Br2
c) Br2, O2, N2, H2
d) Br2, N2, H2, O2
e) O2, Br2, N2, H2.
5) Considere as espécies químicas:
Há ligações covalentes ligando átomos e ligações de hidrogênio ligando moléculas em
a) I, somente.
b) II, somente.
c) III, somente.
d) I e II, somente.
e) I, II e III.
6) Os insetos mostrados na figura não afundam na água devido ao (a)
a) presença de pontes de hidrogênio, em função da elevada polaridade da molécula de água.
b) fato de os insetos apresentarem uma densidade menor que a da água.
c) elevada intensidade das forças de dispersão de London, em conseqüência da polaridade das moléculas de água.
d) interação íon – dipolo permanente, originada pela presença de substâncias iônicas dissolvidas na água.
e) imiscibilidade entre a substância orgânica que recobre as patas dos insetos e a água.
7) A geometria molecular e a polaridade das moléculas são conceitos importantes para predizer o tipo de força de interação entre elas. Dentre os compostos moleculares nitrogênio, dióxido de enxofre, amônia, sulfeto de hidrogênio e água, aqueles que apresentam o menor e o maior ponto de ebulição são, respectivamente,
a) SO2 e H2S.
b) N2 e H2O.
c) NH3 e H2O.
d) N2 e H2S.
e) SO2 e NH3.
8) No tocante a ligações de hidrogênio, é correto afirmar que:
a) ligações de hidrogênio ocorrem somente entre moléculas e nunca dentro de uma mesma molécula.
b) o ponto de fusão da água é menor que o do sulfeto de hidrogênio, por conta das ligações de hidrogênio, que são muito intensas na molécula de água.
c) ligações de hidrogênio têm a mesma energia que uma ligação covalente simples.
d) ligações de hidrogênio podem influenciar na densidade de uma substância.
e) átomos de hidrogênio ligados covalentemente a átomos de oxigênio não podem participar de ligações de hidrogênio.
9) (FRANCISCANA) Quando a substância hidrogênio passa do estado líquido para o estado gasoso, são rompidas:
a) ligações de Van der Waals
b) pontes de hidrogênio
c) ligações covalentes e pontes de hidrogênio
d) ligações covalentes apolares
e) ligações covalentes polares
10) (FEI) Qual o tipo de interação que se manifesta:
a) entre moléculas NH3 (l)?
b) entre moléculas CH4 (l)?
11) (ABC) Entre as moléculas abaixo, a que forma pontes de hidrogênio entre suas moléculas é:
a) CH4
b) CH3 - CH2 - OH
c) CH3 - O - CH3
d) C2H6
e) N(CH3)3
12) A água tem maior ponto de ebulição, porque apresenta:
a) molécula com 10 elétrons
b) geometria angular
c) hibridação sp3
d) ligações por pontes de hidrogênio
e) ligações do s - p
a) molécula com 10 elétrons
b) geometria angular
c) hibridação sp3
d) ligações por pontes de hidrogênio
e) ligações do s - p
13) (FEI) Qual o tipo de ligação responsável pelas atrações intermoleculares nos líquidos e sólidos constituídos de moléculas apolares?
14) (PUC) As pontes de hidrogênio aparecem:
a) ligação covalente apolar.
b) ligação covalente polar.
c) ligação iônica.
d) ligação de hidrogênio.
e) força de Van der Waals.

a) quando o hidrogênio está ligado a um elemento muito eletropositivo;
b) quando o hidrogênio está ligado a um elemento muito eletronegativo;
c) em todos os compostos hidrogenados;
d) somente em compostos inorgânicos;
e) somente nos ácidos de Arrhenius.
15) A trimetilamina e a propilamina possuem exatamente a mesma massa molecular e, no entanto, pontos de ebulição (Pe) diferentes. O tipo de força intermolecular que explica esse fato é:
a) ligação covalente apolar.
b) ligação covalente polar.
c) ligação iônica.
d) ligação de hidrogênio.
e) força de Van der Waals.

16) Considere separadamente as substâncias líquidas tetracloreto de carbono, água, n-hexano e acetona, listadas na tabela de interações intermoleculares, nessa ordem. As interações mais fortes entre as espécies constituintes estão indicadas corretamente em
a) I
b) II
c) III
d) IV
e) V

a) I
b) II
c) III
d) IV
e) V

17) Observe a tabela de pontos de ebulição: O ponto de ebulição da água é anômalo em relação aos demais compostos da família do oxigênio porque:
a) as moléculas da água são mais leves.
b) existem pontes de hidrogênio entre as moléculas da água.
c) existem Forças de Van Der Waals entre as moléculas da água.
d) somente a molécula da água é apolar.
e) as demais substâncias decompõem-se termicamente.

a) as moléculas da água são mais leves.
b) existem pontes de hidrogênio entre as moléculas da água.
c) existem Forças de Van Der Waals entre as moléculas da água.
d) somente a molécula da água é apolar.
e) as demais substâncias decompõem-se termicamente.

18) Assinale a opção que contém a fórmula de um composto que pode formar pontes de hidrogênio:
a) CH3CH2COONa
b) CH3CH2CH3
c) CH3CH2OCH2CH3
d) CH3CH2OH
e) CH2CHCH2CH3
a) ligação de hidrogênio, dipolo temporário, dipolo permanente
b) ligação de hidrogênio, ligação de hidrogênio, dipolo temporário
c) dipolo temporário, dipolo permanente, ligação de hidrogênio
d) dipolo temporário, ligação de hidrogênio, dipolo permanente
e) dipolo permanente, ligação de hidrogênio, dipolo temporário.
a) CH3CH2COONa
b) CH3CH2CH3
c) CH3CH2OCH2CH3
d) CH3CH2OH
e) CH2CHCH2CH3
19) Considere as seguintes interações:I - CH4 CH. CH4 II - HBr , HBr III - CH3OH CH. H2OAs forças intermoleculares predominantes que atuam nas interações I, II e III são, respectivamente:
a) ligação de hidrogênio, dipolo temporário, dipolo permanente
b) ligação de hidrogênio, ligação de hidrogênio, dipolo temporário
c) dipolo temporário, dipolo permanente, ligação de hidrogênio
d) dipolo temporário, ligação de hidrogênio, dipolo permanente
e) dipolo permanente, ligação de hidrogênio, dipolo temporário.
20) Sobre a temperatura de ebulição de um líquido são feitas as afirmações:
a) ao rompimento da ligação entre as unidades de glicose e frutose.
b) às ligações de hidrogênio resultantes da interação da água com a sacarose.
c) às forças de van der Waals, resultantes da interação da água com a unidade de glicose desmembrada.
d) às forças de dipolo-dipolo, resultantes da interação da água com a unidade de frutose desmembrada.
e) às forças de natureza íon-dipolo, resultantes da interação do dipolo da água com a sacarose.

I.Aumenta com o aumento da força da ligação química INTRAmolecular.
II.Aumenta com o aumento da força da ligação química INTERmolecular.
III.Aumenta com o aumento da pressão exercida sobre o líquido. IV. Aumenta com o aumento da quantidade de sólido dissolvido.Estão CORRETAS:
a) Apenas I e II
b) Apenas I e IV.
c) Apenas III e IV.
d) Apenas II, III e IV
e) Todas.
21) Água e etanol são dois líquidos miscíveis em quaisquer proporções devido a ligações intermoleculares, denominadas:
a) iônicas
b) pontes de hidrogênio
c) covalentes coordenadas
d) dipolo induzido - dipolo induzido
22) As propriedades dos sólidos podem, muitas vezes, ser interpretadas em função das ligações químicas entre suas unidades estruturais. O diamante, o naftaleno e o óxido de magnésio apresentam, respectivamente, ligações do tipo
a) van der Waals, covalente, metálica.
b) covalente, iônica, metálica.
c) covalente, van der Waals, metálica.
d) van der Waals, covalente, iônica.
e) covalente, van der Waals, iônica.
23) Um iceberg é composto por moléculas de água que se mantêm fortemente unidas por meio de interações do tipo
a) dipolo induzido-dipolo permanente.
b) dipolo instantâneo-dipolo induzido.
c) ligações covalentes dativas.
d) ligações covalentes.
e) ligações de hidrogênio.
24) A mãe de Joãozinho, ao lavar a roupa do filho após uma festa, encontrou duas manchas na camisa: uma de gordura e outra de açúcar. Ao lavar apenas com água, ela verificou que somente a mancha de açúcar desaparecera completamente. De acordo com a regra segundo a qual "semelhante dissolve semelhante", assinale a opção que contém a força intermolecular responsável pela remoção do açúcar na camisa de Joãozinho.
a) Ligação iônica.
b) Ligação metálica.
c) Ligação covalente polar.
d) Forças de London.
e) Ponte de hidrogênio.
25) A sacarose (açúcar comum), cuja estrutura é mostrada na figura, é um dissacarídeo constituído por uma unidade de glicose ligada à frutose. A solubilidade da sacarose em água deve-se
a) ao rompimento da ligação entre as unidades de glicose e frutose.
b) às ligações de hidrogênio resultantes da interação da água com a sacarose.
c) às forças de van der Waals, resultantes da interação da água com a unidade de glicose desmembrada.
d) às forças de dipolo-dipolo, resultantes da interação da água com a unidade de frutose desmembrada.
e) às forças de natureza íon-dipolo, resultantes da interação do dipolo da água com a sacarose.

26) A gasolina é uma mistura de hidrocarbonetos, dos quais o octano pode ser tomado como representante. Sua estrutura, bem como a da sacarose, é mostrada a seguir. Sobre as estruturas acima, qual das afirmações é INCORRETA?
a) A molécula de n-octano é apolar.
b) Entre moléculas de açúcar podem ocorrer ligações de hidrogênio.
c) As forças intermoleculares no n-octano são mais fracas que as que ocorrem entre as moléculas de açúcar.
d) Ocorrem ligações de hidrogênio entre as moléculas de n-octano e as de açúcar.
e) As forças intermoleculares no n-octano são denominadas dipólo induzido-dipólo induzido.
Gabarito:
1) B 2) B. As moléculas 1 e 4 possuem forças de Van der Waals do tipo dipolo induzido, porque elas são hidrocarbonetos, possuindo somente os átomos de carbono e hidrogênio e, portanto, são apolares. Já as moléculas das substâncias 2 e 3 possuem o grupo hidroxila, ou seja, o H ligado ao O e, devido a isso, a interação intermolecular que se estabelece é uma ligação de hidrogênio.
3) Em I são rompidas as pontes de hidrogênio existentes na água líquida, permitindo sua passagem para o estado gasoso. Em II são rompidas as ligações covalentes entre o hidrogênio e o oxigênio, quebrando as moléculas de água e dando origem ao hidrogênio e ao oxigênio.
4) A 5) E 6) A 7) B 8) D 9) A 10) a) Ponte de hidrogênio b) Dispersões de London
11) B 12) D 13) Forças de Van der Walls, do tipo Dispersões de London. 14) B 15) D 16) C 17) B 18) D
19) C 20) D 21) B 22) E 23) E 24) E 25) B 26) D

Uma observação: A resposta da questão 01 está incorreta. Vejamos a questão:
ResponderExcluir01.(PUC-PR) O dióxido de carbono, presente na atmosfera e nos extintores de incêndio, apresenta ligação entre os seus átomos do tipo....... e suas moléculas estão unidas por ....... .
Os espaços acima são corretamente preenchidos pela alternativa:
a) covalente apolar - forças de Van der Waals
b) covalente apolar - atração dipolo induzido-dipolo induzido
c) covalente polar - ligações de hidrogênio
d) covalente polar - forças de Van der Waals
e) covalente polar - atração dipolo-dipolo.
As ligações C=O são polares devido à diferença de eletronegatividade entre os átomos envolvidos; a molécula de CO2 é que será apolar em virtude do momento dipolo resultante ser nulo. Como são apolares, as moléculas interagem através de forças de Van der Waals. Logo a alternativa correta será a D, e não a B.
Oi Rogézio, dióxido de carbono é CO2 O=C=O, então é apolar!
ExcluirMaria, tens razão ao dizer que A MOLÉCULA É APOLAR. Mas tal como o Rogézio mencionou, e bem, AS LIGAÇÕES C=O SÃO POLARES: como o oxigénio é o elemento mais eletronegativo, é ele que tem a carga parcial negativa. E como os momentos dipolares das ligações são simétricos, o momento dipolar é nulo, ou seja, a molécula é apolar.
ExcluirA " ligação entre os seus átomos ", tal como diz a pergunta, é POLAR. Sendo a MOLÉCULA APOLAR, as forças intermoleculares que afetaram as ligações dessas moléculas são as forças de London (dipolo induzido-dipolo instantâneo), sendo essa uma FORÇA DE VAN DER WAALS.
Por isso, sim, a resposta correta seria a D e não a B
Ncepsicredri_1993 Timothy Wilson https://marketplace.visualstudio.com/items?itemName=0innabira.Descargar-Antitetrise-gratuita
ResponderExcluiratneystinem
Mlincfacia_pu Kenneth Thompson https://www.ilonainen.fi/profile/hollycedelaneycallan/profile
ResponderExcluirprofilnisi
YplicmoYmyrr-a_West Valley City Irla Burns click
ResponderExcluirboatratealin
cludassine Susan Ortega click here
ResponderExcluirbapcompmondse