Transformações gasosas
Lei de Charles
O físico francês Jacques Alexandre César Charles realizou estudos sobre gases que resultaram em importantes descobertas. Dentre elas, concluiu que havia um crescimento proporcional no volume de qualquer gás ao ser aquecido, equivalente a 1/273 de seu valor inicial a 0ºC. Desta forma, pode postular que a zero kelvin, que correspondem a aproximadamente -273ºC, o volume encerrado por um gás seria igual a zero. Mais tarde o cientista inglês kelvin denomina isto como sendo o zero absoluto.
Considere um gás confinado em um sistema fechado cujo volume pode variar, sem que sua pressão varie, conforme mostra a figura 01.
Figura 01: sistema fechado de volume variável mantido a pressão constante
A variação no volume é linear. Matematicamente, a lei de Charles é expressa:
V = k.T
Sendo k uma constante de proporcionalidade.
O gráfico VxT a seguir representa a função V = k.T
O gráfico VxT a seguir representa a função V = k.T
Figura 02: gráfico VXT representando a variação linear do volume com a temperatura
Obs.: Estes três processos ocorrem lentamente de modo que haja tempo o suficiente para ocorrer o equilíbrio térmico entre o gás e o ambiente.
Charles não publicou seus resultados. Mais tarde, estes resultados foram também encontrados e publicados em 1802 por Gay-Lussac em estudo realizado de forma independente, de modo que esta lei também ficou conhecida como lei de Gay-Lussac.
Charles foi o primeiro a utilizar o hidrogênio para encher balões aerostáticos, conforme mostra a figura 03.
Figura 03: ilustração de um balão aerostático
A lei de Boyle
Essa lei foi formulada pelo químico irlandês Robert Boyle (1627-1691) e descreve o comportamento do gás ideal quando se mantém sua temperatura constante (transformação isotérmica). Considere um recipiente com tampa móvel que contem certa quantidade de gás.
 |
Aplica-se lentamente uma força sobre essa tampa, pois desse modo não alteraremos a temperatura do gás.
 |
Observaremos um aumento de pressão junto com uma diminuição do volume do gás, ou seja, quando a temperatura do gás é mantida constante, pressão e volume são grandezas inversamente proporcionais. Essa é a lei de Boyle, que pode ser expressa matematicamente do seguinte modo:
| p=kV oupV=k |
Onde k é uma constante que depende da temperatura, da massa e da natureza do gás. A transformação descrita é representada na figura a seguir em um diagrama de pressão por volume:
Na matemática, essa curva é conhecida como hipérbole equilátera.
A lei de Gay-Lussac
A lei de Gay-Lussac nos mostra o comportamento de um gás quando é mantida a sua pressão constante e variam-se as outras duas grandezas: temperatura e volume. Para entendê-la, considere novamente um gás em um recipiente de tampa móvel. Dessa vez, nós aqueceremos o gás e deixaremos a tampa livre, como mostra a figura abaixo:
Feito isso, veremos uma expansão do gás junto com o aumento de temperatura. O resultado será uma elevação da tampa e, consequentemente, um aumento de volume. Observe que a pressão sobre a tampa - nesse caso a pressão atmosférica - se mantém constante.
A lei de Gay-Lussac diz que em uma transformação isobárica (pressão constante), temperatura e volume são grandezas diretamente proporcionais. Essa lei é expressa matematicamente da seguinte forma:
| v=k.T ouVT=k |
Onde k é uma constante que depende da pressão, da massa e da natureza do gás.
Em um gráfico do volume em função da temperatura, teremos o seguinte resultado:
Em um gráfico do volume em função da temperatura, teremos o seguinte resultado:
A Equação de Clapeyron
Vimos através das três leis anteriores como um gás perfeito se comporta quando mantemos uma variável constante e variamos as outras duas. A equação de Clapeyron pode ser entendida como uma síntese dessas três leis, relacionando pressão, temperatura e volume.
Em uma transformação isotérmica, pressão e volume são inversamente proporcionais e em uma transformação isométrica, pressão e temperatura são diretamente proporcionais. Dessas observações, podemos concluir que a pressão é diretamente proporcional à temperatura e inversamente proporcional ao volume.
É importante também salientar que o número de moléculas influencia na pressão exercida pelo gás, ou seja, a pressão também depende diretamente da massa do gás. Considerando esses resultados, Paul Emile Clapeyron (1799-1844) estabeleceu uma relação entre as variáveis de estado com a seguinte expressão matemática:
Em uma transformação isotérmica, pressão e volume são inversamente proporcionais e em uma transformação isométrica, pressão e temperatura são diretamente proporcionais. Dessas observações, podemos concluir que a pressão é diretamente proporcional à temperatura e inversamente proporcional ao volume.
É importante também salientar que o número de moléculas influencia na pressão exercida pelo gás, ou seja, a pressão também depende diretamente da massa do gás. Considerando esses resultados, Paul Emile Clapeyron (1799-1844) estabeleceu uma relação entre as variáveis de estado com a seguinte expressão matemática:
      |
Onde n é o número de mols e R é a constante universal dos gases perfeitos. Essa constante pode assumir os seguintes valores:
                            |
A equação geral dos gases perfeitos
Considere uma determinada quantidade de gás ideal confinado em um recipiente onde se pode variar a pressão, o volume e a temperatura, mas mantendo-se a massa constante, ou seja, sem alterar o número de mols.
A partir da equação de Clapeyron, podemos estabelecer a seguinte relação:
A partir da equação de Clapeyron, podemos estabelecer a seguinte relação:
             |
Como foi descrito o número de mols n e R são constantes. Conclui-se então:
             |
Isto é, se variarmos a pressão, o volume e a temperatura do gás com massa constante, a relação acima sempre dará o mesmo resultado. Para entender melhor o que isso significa, observe a figura abaixo:
Temos o gás ideal em três estados diferentes, mas se estabelecermos a relação de pressão, volume e temperatura descritos na primeira equação, chega-se aos seguintes resultados.
         |
         |
         |
Observe que as três equações dão o mesmo resultado, o que significa que elas são iguais. Então, podemos obter a seguinte equação final:
                    |
Essa relação é conhecida como a equação geral dos gases perfeitos.
Teoria Cinética dos Gases
A teoria cinética dos gases foi desenvolvida a partir da aplicação das leis da Mecânica de Newton aos sistemas microscópicos dos gases, ou seja, às suas partículas. Para tal aplicação, vamos supor as seguintes hipóteses:
1a) Todas as moléculas se encontram em movimento desordenado.
2a) As moléculas não exercem forças umas sobre as outras, exceto quando colidem.
3a) Os choques entre as moléculas e com as paredes do recipiente são perfeitamente elásticos.
4a) As moléculas têm dimensões desprezíveis em comparação com os espaços vazios que as separam.
5a) Entre os choques, as moléculas se movem em MRU (movimento retilíneo uniforme).
Pressão de um Gás
As moléculas de um gás estão em constante e desordenado movimento, chocando-se com as paredes do recipiente, causando o aparecimento de uma força, que age contra as paredes e, conseqüentemente, exercendo uma pressão.
A pressão devida às colisões das moléculas, em função da velocidade média das moléculas de um gás, é:
Em que:

Questões
1) (UFMG 2006) Regina estaciona seu carro, movido a gás natural, ao Sol. Considere que o gás no reservatório do carro se comporta como um gás ideal. Assinale a alternativa cujo gráfico melhor representa a pressão em função da temperatura do gás na situação descrita.
Solução:
A primeira coisa que temos que ver é o tipo do gráfico. Na questão temos gráficos de Pressão x Temperatura.
A segunda coisa é o que é constante na questão. Nesse caso, ele fala que o gás está em um reservatório de GNV – daquele tipo que temos nos carros. Esses reservatórios dilatam muito pouco, é quase desprezível, logo, seu volume não muda. Então podemos afirmar que o volume desse gás será constante, já que o gás ocupa todo o reservatório sempre.
Agora que sabemos que seu volume é constante, vemos que a questão se trata de uma transformação isométrica ou isovolumétrica – é a mesma coisa. Um gráfico de transformação isométrica de Pressão x Temperatura é sempre uma reta inclinada. Isso sai da fórmula P/T=P0/T0. Uma igualdade de razões nos dará uma reta inclinada.
Por que não é letra B ? Porque o gráfico da letra B está dizendo que a pressão é constante. Esse gráfico seria de uma transformação isobárica.
Logo, o gabarito é letra D.
2) Num determinado instante o recipiente I contém 10 litros de gás, a temperatura ambiente e pressão de 2,0 atm, enquanto o recipiente II está vazio. Abrindo-se a torneira, o gás se expande, exercendo pressão de 0,50 atm, enquanto retorna à temperatura ambiente. O volume do recipiente II, em Litros, vale:
a)80
b)70
c)40
d)30
e)10
SOLUÇÃO:
Retirando os dados:
P1 - pressão inicial= 2,0 atm
P2 - pressão final = 0,50 atm
V2 - volume final= V1 + X = 10 + X;
X é o volume do recipiente II
V1 - volume inicial = 10 L)
Lei de Boyle-Mariotte:
P1/P2 = V2/V1 Substituindo, temos:
2,0 / 0,50 = 10 + X / 10
4,0 x 10 = 10 + X
X = 40,0 - 10
x = 30 L
Resposta letra d
a) Qual será o volume do lado esquerdo quando a parede móvel estiver equilibrada?
b) Qual é a pressão nos dois lados, na situação de equilíbrio?
a) Para resolver a primeira questão do exercício devemos observar que, se a parede móvel está equilibrada a pressão para os dois lados será igual. Logo:

Como sabemos que Vd + Ve = 2, já que o cilindro tem 2,0 litros de volume, podemos dizer que:
2ve + ve = 2
3 ve = 2
Ve = 2/3
Ve = 0,67litro

P1 - pressão inicial= 2,0 atm
P2 - pressão final = 0,50 atm
V2 - volume final= V1 + X = 10 + X;
X é o volume do recipiente II
V1 - volume inicial = 10 L)
Lei de Boyle-Mariotte:
P1/P2 = V2/V1 Substituindo, temos:
2,0 / 0,50 = 10 + X / 10
4,0 x 10 = 10 + X
X = 40,0 - 10
x = 30 L
Resposta letra d
3 ) Um gás de volume 0,5m³ à temperatura de 20ºC é aquecido até a temperatura de 70ºC. Qual será o volume ocupado por ele, se esta transformação acontecer sob pressão constante?
Solução:
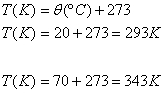
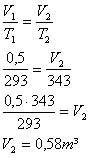
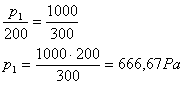 5) Um cilindro de 2,0 litros é dividido em duas partes por uma parede móvel fina, conforme o esquema acima. O lado esquerdo do cilindro contém 1,0 mol de um gás ideal. O outro lado contém 2,0 mols do mesmo gás. O conjunto está à temperatura de 300k. Adote R = 0,080 atm.l/mol.K.
5) Um cilindro de 2,0 litros é dividido em duas partes por uma parede móvel fina, conforme o esquema acima. O lado esquerdo do cilindro contém 1,0 mol de um gás ideal. O outro lado contém 2,0 mols do mesmo gás. O conjunto está à temperatura de 300k. Adote R = 0,080 atm.l/mol.K.
Solução:
É importante lembrarmos que a temperatura considerada deve ser a temperatura absoluta do gás (escala Kelvin) assim, o primeiro passo para a resolução do exercício é a conversão de escalas termométricas:
Lembrando que:
Então:
4 ) Um gás que se encontra à temperatura de 200K é aquecido até 300K, sem mudar de volume. Se a pressão exercida no final do processo de aquecimento é 1000Pa, qual era a pressão inicial?
Solução:
Solução:
a) Qual será o volume do lado esquerdo quando a parede móvel estiver equilibrada?
b) Qual é a pressão nos dois lados, na situação de equilíbrio?
Solução:
a) Para resolver a primeira questão do exercício devemos observar que, se a parede móvel está equilibrada a pressão para os dois lados será igual. Logo:

Como sabemos que Vd + Ve = 2, já que o cilindro tem 2,0 litros de volume, podemos dizer que:
2ve + ve = 2
3 ve = 2
Ve = 2/3
Ve = 0,67litro
b) Para encontrarmos o valor da pressão em qualquer um dos lados, basta substituirmos os valores na equação abaixo:

6) (FGV SP/2012)
O Brasil é um grande exportador de frutas frescas, que são enviadas por transporte marítimo para diversos países da Europa. Para que possam chegar com a qualidade adequada ao consumidor europeu, os frutos são colhidos prematuramente e sua completa maturação ocorre nos navios, numa câmara contendo um gás que funciona como um hormônio vegetal, acelerando seu amadurecimento. Esse gás a 27 ºC tem densidade 1,14 g * L–1 sob pressão de 1,00 atm. A fórmula molecular desse gás é ( C = 12 H = 1 O = 16 Xe = 131,3 N = 14 )
a) Xe.
b)O3.
c) CH4.
d)C2H4.
e) N2O4.
Solução:
A questão informa que d = 1,14 g/L , P = 1 atm T = 300K R = 0,082 atm.L/mol.K.
Encontrando o valor da massa molar, conseguimos a fórmula molecular da substância.
M = d R T / P M = 1,14 . 0,082 . 300 / 1 → M = 28,0 g.mol-1
Através dos valores de massa fornecidos, a substância com massa molar igual a 28 é o C2H4 ( eteno ). Letra D
7) (MACK SP/2013)
Considerando dois gases com comportamento ideal, CH4 e C2H6, contidos em compartimentos separados e fechados, ambos com volumes iguais a 10 L, sob mesmas condições de temperatura e pressão, de acordo com a hipótese de Avogadro, pode-se afirmar que ambos os gases
a) contêm a mesma quantidade de moléculas. b) possuem a mesma massa.
c) possuem a mesma massa molar. d) contêm, respectivamente, 2 e 5 mols.
e) possuem iguais velocidades de difusão.
Solução:
Hipótese de Avogadro : Volumes iguais de dois quaisquer gases na mesma temperatura e pressão, possuem o mesmo número de mols ( moléculas ).
A própria hipótese de Avogrado já resolve a questão, pois a mesma afirma que o volume é de 10 litros na mesma pressão e temperatura, indicando que temos o mesmo número de moléculas e de mols.
8) (FAMECA SP/2014)
Um médico prescreveu ao seu paciente o uso de gás oxigênio medicinal para realização de oxigenoterapia. Em um cilindro do gás recomendado eram encontradas as informações reportadas na figura.

Considere que todo o gás contido no cilindro indicado na figura, quando submetido à pressão de 1 bar e 25 ºC, ocupa um volume de 1,5 m3. É correto afirmar que o volume de oxigênio medicinal, nesse cilindro, em litros, é
a)50.
b)10.
c) 25.
d)15.
e) 5.
Solução:
DICA: Temos que tomar cuidado, pois a capacidade do cilindro é de 150 bar, e o volume é de 1,5 m3, porém a questão quer saber o volume em litros em 1 bar ≅ 1 atm.
Dados: P1 = 1 bar T = 298 K V1 = 1,5 m3 = 1500 L P2 = 150 bar T = 298 K
P1V1 = P2V2 → V2 = 1 . 1500 / 150 → V2 = 10 L
9) Qual a velocidade média das moléculas de um gás que ocupa um recipiente de capacidade igual a 2 litros, tem massa igual a 20 gramas e pressão equivalente a 2 atmosferas?
Solução:
Lembrando que existe uma relação entre estas grandezas expressa por:
Podemos isolar a grandeza que desejamos calcular, ou seja, a velocidade:
Convertendo os dados do problema para grandezas do SI:
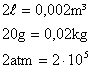
Utilzando os dados na equação:
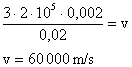
Solução:
Como a temperatura não é modificada durante a transformação, esta é Isotérmica, sendo regida pela equação:
Neste caso não é necessário converter as unidades para o SI pois ambas têm mesma característica, ou seja volume é expresso em litros e pressão em atm, portanto, a pressão final será dada em atm:
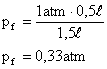
Solução:
Utilizando a Equação de Clapeyron para ambas situações podemos chegar a um sistema de equações:
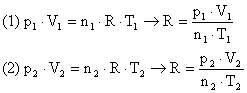
Igualando as equações:
A temperatura deve ser passada para escala absoltura para que não haja indeterminações nos cálculos:
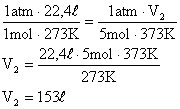
Solução:
Como o volume não varia durante a transformação, esta é Isométrica, sendo regida por:

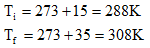
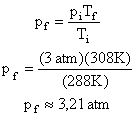 13) Qual a energia cinética média das moléculas de 10 mols de um gás perfeito, na temperatura de 100°C? E na temperatura de 100K? Considere R=8,31 J/mol.K
13) Qual a energia cinética média das moléculas de 10 mols de um gás perfeito, na temperatura de 100°C? E na temperatura de 100K? Considere R=8,31 J/mol.K
Como o volume não varia durante a transformação, esta é Isométrica, sendo regida por:
Mas as temperaturas devem ser medidas em escala absoluta, ou seja:
Isolando-se a pressão final:
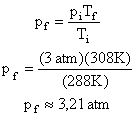
Solução:
Sabemos que a energia cinética média das moléculas de um gás é dado por:
No entanto a temperatura utilizada é a absoluta, por isso deve ser convertida, para o primeiro caso:
Aplicando estes valores na equação:
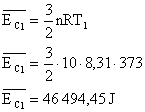
Para o segundo caso (T=100K):
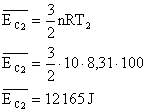
Nº DE MOLÉCULAS
|
VOLUME
| |
P, T CONSTANTES
|
N1
|
V1
|
N2
|
V2
| |
N3
|
V3
|
a) Qual a expressão que relaciona esses números de moléculas com os respectivos volumes?
b) Como se enuncia a lei que relaciona esses dados?
Solução:
a) V = K n
b) Se a pressão e a temperatura são constantes, o volume ocupado pelo gás é diretamente proporcional ao nº de moléculas. (Hipótese de Avogrado)
b) Se a pressão e a temperatura são constantes, o volume ocupado pelo gás é diretamente proporcional ao nº de moléculas. (Hipótese de Avogrado)
15) (UFU-MG) As grandezas que definem completamente o estado de um gás são:
a) somente pressão e volume
b) apenas o volume e a temperatura.
c) massa e volume.
d) temperatura, pressão e volume.
e) massa, pressão, volume e temperatura.
16) Uma câmara fechada, de paredes rígidas, contém ar e está sob pressão atmosférica e à temperatura de 20°C. Para dobrar a pressão na câmara, o ar deve ser esquentado para:
(A) 546°C
(B) 586°C
(C) 40°C
(D) 293°C
(E) 313°C
Solução:
Aplicando-se a equação de estado dos gases ideais,
PV= n R T,
a este processo, no qual o volume se mantém constante, verifica-se que, para dobrar a pressão, é necessário dobrar a temperatura.
Na escala Kelvin, a temperatura inicial é Ti = 273 + 20 = 293 K. Portanto, a temperatura final deve ser
Tf = 2Ti = 586 K.
Logo, Tf = 586 - 273 = 313° C. Letra E
17) Numa transformação isotérmica de um gás ideal, o produto p V é constante e vale 33.240J. A constante dos gases perfeitos é 8,31J/mol.K e o número de mols do gás é n=5. Durante o processo, o gás recebe do meio exterior 2.000 J do calor. Determine:
a) Se o gás esta sofrendo expansão ou compressão;
Recebendo calor, o gás realiza trabalho sobre o meio exterior e, portanto, se expande. O processo em questão é uma expansão isotérmica.
b) A temperatura do processo;
Sendo p.V=33.240J, n=5 R=8,31 J/mol.k e aplicando a equação de Clapeyron, resulta:
p.V=n.R.T
33.240=5x8,31xT
T=800 K
c) A variação da energia interna do gás;
Numa transformação isotérmica, não havendo variação de temperatura, é nula a variação de energia interna e de acordo com a lei do Joule, temos:
∆T=0
∆U=0
d) O trabalho realizado na transformação.
O gás recebe 2000J de calor: Q=2000J. Pela primeira lei da Termodinâmica temos:
∆U=Q-T
0=Q-T
T=Q
T=2000J
Assim o trabalho realizado é de T=2000J.
a) a energia recebida pelo gás na forma de calor é igual ao trabalho realizado pelo gás na expansão.
b) não troca energia na forma de calor com o meio exterior.
c) não troca energia na forma de trabalho com o meio exterior.
d) a energia recebida pelo gás na forma de calor é igual à variação da energia interna do gás.
e) o trabalho realizado pelo gás é igual à variação da energia internado gás.
Solução:
A energia recebida pelo gás na forma de calor é igual ao trabalho realizado pelo gás na expansão. Letra A
19) Considerando que um gás ocupa 4 litros em um dado recipiente e sua pressão é desconhecida, o que aconteceria se colocássemos esse mesmo gás em outro espaço com capacidade para 2 litros?
Dados: pressão do gás no 2° recipiente = 1520 mm Hg
Qual seria a pressão do gás no 1° recipiente?
Solução:
Equação para gás ideal:

Equação para gás ideal:

- E se um gás ideal ocupa 4 litros a uma temperatura de 300 K. Se alterarmos sua temperatura para 900 K, qual seria seu novo volume?

20) Considere as afirmações abaixo, sobre gases ideais.
I – A constante R presente na equação de estado de gases pV = nRT tem o mesmo valor para todos os gases ideais.
II – Volumes iguais de gases ideais diferentes, à mesma temperatura e pressão, contêm o mesmo número de moléculas.
III – A energia cinética média das moléculas de um gás ideal é diretamente proporcional à temperatura absoluta do gás.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas III.
(D) Apenas I e II.
(E) I, II e III.
21) Certa quantidade de ar, aprisionada numa seringa de injeção à pressão atmosférica, ocupa o volume de 10,0 cm3 à temperatura de 0 °C. Suponha que essa seringa seja vedada e imersa em água quente, atingindo, no equilíbrio térmico, a temperatura de 80,0 °C. Observa-se que o êmbolo sobe até atingir a marca correspondente a um novo volume. Admitindo que a pressão do ar no interior da seringa permaneça constante, esse volume, em cm3, é de
(A) 15,0.(B) 13,7.
(C) 12,9.
(D) 12,1.
(E) 11,2.
Solução:
V1 = 10 cm3
T1 = 0 + 273 = 273 K
T2 = 80 + 273 = 353 K
Da lei geral dos gases ideais, temos:
P1V1/T1 = P2V2/T2
mas P1 = P2
então V1/T1 = V2/T2
10/273 = V2/353
V2 = 3530/273 = 12,9 cm3 Letra C.
T2 = 80 + 273 = 353 K
Da lei geral dos gases ideais, temos:
P1V1/T1 = P2V2/T2
mas P1 = P2
então V1/T1 = V2/T2
10/273 = V2/353
V2 = 3530/273 = 12,9 cm3 Letra C.
Solução:
p = F
F = p A = 5,0 · 10 · 2,0 (N)
F = 1,0 · 10 N
23) (FCMSC-SP) Uma amostra de gás perfeito ocupa um recipiente de 10,0 à pressão de 1,5 atm. Essa amostra foi transferida para outro recipiente de 15,0 litros, mantendo a mesma temperatura. Qual a nova pressão dessa amostra de gás?
Solução:
Lei de Boyle: p V = p V
1,5 · 10,0 = p · 15,0 p = 1,0 atm
24) (PUC-SP) Um recipiente contém certa massa de gás ideal que, à temperatura de 27 °C, ocupa um volume de 15 . Ao sofrer uma transformação isobárica, o volume ocupado pela massa gasosa passa a ser de 20 . Nessas condições, qual foi a variação de temperatura sofrida pelo gás?
Solução:
Lei de Charles e Gay-Lussac: V
T = 400 K = 127 °C
Assim:
ΔT (°C) = (127 – 27) °C
ΔT (°C) = 100 °C
25) (PUC-SP) Determinada massa de gás perfeito sofre uma transformação isométrica. A pressão inicial vale 4,0 atm e a temperatura inicial é de 47 °C. Se a temperatura final é de 127 °C, qual é o valor da pressão final?
Solução:
Lei de Charles: p
T = p T
(47 + 273) = p (127 + 273) p = 5,0 atm
26) (Ufal) Um gás ideal está contido em um recipiente fechado, a volume constante, a uma temperatura de 27 °C. Para que a pressão desse gás sofra um acréscimo de 50%, é necessário elevar a sua temperatura para quanto?
Solução:
Lei de Charles: p
T = p T p(27 + 273) = 1,5 p T
Resposta: 177 °C isotermas, Te T .
27) (Fuvest-SP) Um congelador doméstico (freezer) está regulado para manter a temperatura de seu interior a –18 °C. Sendo a temperatura ambiente igual a 27 °C (ou seja, 300 K), o congelador é aberto e, pouco depois, fechado novamente. Suponha que o freezer tenha boa vedação e que tenha ficado aberto o tempo necessário para o ar em seu interior ser trocado por ar ambiente. Quando a temperatura do ar no freezer voltar a atingir –18 °C, a pressão em seu interior será:
a) cerca de 150% da pressão atmosférica. b) cerca de 118% da pressão atmosférica.
c) igual à pressão atmosférica. d) cerca de 85% da pressão atmosférica.
e) cerca de 67% da pressão atmosférica.
Solução:
Lei de Charles: p
T = p
T ⇒ p(27 + 273)
= p (–18 + 273) p = 0,85 p A pressão no interior do freezer é 85% da pressão atmosférica.
Resposta: Letra d
28) Certa massa de gás ideal, inicialmente nas CNTP (condições normais de temperatura e pressão: T = 0 °C = 273 K e p = 1,0 atm), sofre uma transformação isobárica e aumenta seu volume em 80%. Em graus Celsius, qual foi a variação de temperatura sofrida por esse gás?
Solução:
CNTp p = 1 atm T = 0 °C = 273 K
Transformação isobárica Lei de Charles e Gay-Lussac:
T ⇒ V273 = 1,8 V (θ + 273) θ = 218,4 °C
Portanto:
Δθ = θ – θ = 218,4 °C – 0 °C
Δθ = 218,4 °C
Resposta: 218,4 °C
29) Certa massa de gás perfeito está em um recipiente de volume constante. No início, a temperatura do gás é de 47 °C e a pressão registrada é equivalente a 100 m Hg. Qual será a nova pressão do gás se a sua temperatura for alterada para 207 °C?
Solução:
Lei de Charles:
T = p T
100(47 + 273) = p (207 + 273) p = 150 m Hg
30) (Unifor-CE) Um pneu de automóvel contém ar sob pressão de 3,0 atm à temperatura de 7,0 °C. Após viagem de 72 km, verifica-se que a temperatura do pneu atinge 47 °C. Considerando o ar um gás ideal e desprezando a variação de volume do pneu, a pressão do ar nessa nova condição vale, em atmosferas:
a) 3,1. b) 3,4 c) 3,7 d) 4,0 e) 4,3
Solução:
Lei de Charles:
T = p T
(7,0 + 273) = p (47 + 273) p 3,4 atm
31) (Mack-SP) Um mol de gás ideal, inicialmente num estado A, ocupa o volume de 5,6 litros. Após sofrer uma transformação isotérmica, é levado ao estado B.
V (litros)
P (atmosferas)
Sabendo que em B o gás está nas CNTP (condições normais de temperatura e pressão), podemos afirmar que em A:
a) a pressão é desconhecida e não pode ser determinada com os dados disponíveis. b) a pressão é de 1,0 atmosfera. c) a pressão é de 2,0 atmosferas. d) a pressão é de 4,0 atmosferas. e) a pressão é de 5,6 atmosferas.
Solução:
Nas CNTp, temos
T = 273 K p = 1,0 atm
Na transformação isotérmica, usamos a Lei de Boyle: p V = p V p · 5,6 = 1,0 · 2,4 p = 4,0 atm
32) Num recipiente rígido de 41 L de capacidade, são colocados 10 mols de um gás perfeito, à temperatura de 177 °C. Qual o valor da pressão exercida por esse gás nas paredes internas do recipiente? Dado: constante universal dos gases perfeitos R = 0,082 atm L/mol K
Solução:
Equação de Clapeyron: p V = n R T p · 41 = 10 · 0,082 · (177 + 273) p = 9,0 atm
33) Num recipiente de paredes rígidas e capacidade igual a 10 L, são colocados 8,0 g de hidrogênio à temperatura de –23 °C. Qual a pressão exercida pelo gás, supondo-se que ele se comporte como um gás perfeito? Dados: R = 0,082 atm L/mol K; mol (H ) = 2 g.
Solução:
Equação de Clapeyron:
p V = n R T p V = mM R T p · 10 = 8,02,0 · 0,082 · (–23 + 273) p = 8,2 atm
34) (PUC-SP) Um certo gás, cuja massa vale 140 g, ocupa um volume de 41 litros, sob pressão de 2,9 atmosferas à temperatura de 17 °C. O número de Avogadro vale 6,02 · 10 e a constante universal dos gases perfeitos é R = 0,082 atm L/mol K. Nessas condições, qual o número de moléculas contidas no gás?
Solução:
| 1 mol | → 6,02 · 10 moléculas |
Resolução: Equação de Clapeyron: p V = n R T 2,9 · 41 = n · 0,082 · (17 + 273) n = 5 mols Portanto: 5 mols → x x = 3,0 · 10 moléculas
35) (UFF-RJ) Até meados do século XVII, a concepção de vácuo, como uma região desprovida de matéria, era inaceitável. Contudo, experiências relacionadas à medida da pressão atmosférica possibilitaram uma nova concepção, considerando o vácuo como uma região onde a pressão é bem inferior à de sua vizinhança. Atualmente, pode-se obter vácuo, em laboratórios, com o recurso tecnológico das bombas de vácuo. Considere que se tenha obtido vácuo à pressão de, aproximadamente, 1,0 · 10 atm à temperatura de 30 K. Utilizando o modelo de gás perfeito, determine o número de moléculas por cm existentes nesse vácuo. Dados: número de Avogadro = 6,02 · 10 moléculas/mol; constante universal dos gases = 8,31 J/mol K; 1 atm = 1,01 · 10 N/m.
Solução:
Equação de Clapeyron:
p V = n R T
Sendo: P = 1,0 · 10 atm = 1,01 · 10 N/m V = 1 cm = 1 · 10 m
R = 8,31 J mol K
T = 300 K
Temos: 1,01 · 10 · 10 = n · 8,31 · 300 ⇒ n = 4,05 · 10 mol
Portanto: 1 mol → 6,02 · 10 moléculas 4,05 · 10 mol → x x = 24,38 · 10 moléculas x 2,4 · 10 moléculas
36) (Faap-SP) Sabe-se que o balão A tem o dobro da capacidade do balão B e que ambos contêm o mesmo gás perfeito. No A, o gás está à pressão atmosférica normal e no B, a uma pressão 4 vezes maior, quando ambos estão à mesma temperatura. Calcular a pressão a que estará sujeito o gás após aberta a torneira T, de forma que a temperatura permaneça constante. Dar a resposta em m Hg.
Solução:
Sendo a temperatura constante, temos:
pV = pV + pV p (2V + V) = 760 · 2V + 4 · 760 V p 3V = 1520V + 3040V p = 4560V p = 1520 m Hg
Resposta: 1520 m Hg
37) Num recipiente hermeticamente fechado, encontramos nitrogênio à temperatura de 0 °C. Como o mol do referido gás é igual a 28 g, qual o valor da velocidade média quadrática das suas partículas? Dado: R = 8,31 J/mol K
Solução:
T = M3R v ⇒ 273 = 0,0283 · 8,31 · v ⇒v 493 m/s Resposta: 493 m/s
38) Um gás perfeito ocupa um volume de 2,0 L e possui uma energia interna igual a 600 J. Qual o valor da pressão desse gás, em atmosferas? Dados: 1 atm = 10 N/m; 1 L = 1 dm = 10 m.
Solução:
U = 32 p V
600 = 32 · p · 2,0 · 10 p = 2,0 · 10 N/m = 2,0 atm
39) (FUVEST) Dois balões esféricos A e B contêm massas iguais de um mesmo gás ideal e à mesma temperatura. O raio do balão A é duas vezes maior do que o raio do balão B. Sendo PA e PB as pressões dos gases nos balões A e B. Pode-se afirmar que PA/PB é igual a: a) ¼ b)1/2 c) 1/8 d) 1/16e) 2
Solução:
PaVa =PbVb (1) já que as temperaturas são iguais. Va=4/3π (2Rb)3(2) e Vb =4/3π (Rb)3 (3) Jogando (2) e (30 em (1) teremos: 8Pa(4/3π (Rb)3) =Pb(4/3π (Rb)3) implica
Pa/Pb =1/8. Letra c
40) (FUVEST) Um balão de vidro indilatável contém 10g de oxigênio a 77°C. Este balão poderá suportar, no máximo, uma pressão interna três vezes superior à que está submetido. Se a temperatura do gás for reduzida a 27°C, a máxima quantidade de oxigênio que ainda pode ser introduzida no balão, nesta temperatura, é de:
a) 25g b) 30g c) 40g d) 60g e) 90g
Solução:
PoVo =noRTo (1) PVo =nRT (2) Dividindo (2) por (1) teremos: PTo/PoT =n/no (3) utilizando os dados do problema teremos: n/no = 3Po*350/300Po implica
n/no =3,5 implica n=3,5no mas n= m/M e no =mo/M implica m=3,5mo m= a nova massa e mo igual a massa inicial = 10g. Logo m = 35g é a nova massa do balão. Como dentro do balão já havia uma masa de 10g, para completar 35g foi introduzida no balão, uma massa de 25g.
Letra a
41) Num recipiente de 41 litros são colocados 5,0 mols de um gás perfeito à temperatura de 300 K. Qual a pressão exercida pelo gás nessas condições?
(R = 0,082 atm ·  /K · mol)
/K · mol)
Resolução
n = 5,0 mols
V = 41 
T = 300 K
p · V = n · R · T
p = 3,0 atm
42) Num recipiente de 8,2 litros são colocados 1,5 mols de um gás perfeito. A qual temperatura deve ser aquecido o conjunto para que a pressão exercida pelo gás atinja 6,0 atm?
(R = 0,082 atm ·  /K · mol)
/K · mol)
Solução:
n = 1,5 mols
V = 8,2 
p = 6,0 atm
p · V = n · R · T
T = 400 K
43) Os recipientes A e B contêm oxigênio nas condições indicadas:

Sendo 0,5 kg a massa de gás contida no recipiente A, pede-se calcular a massa de oxigênio no recipiente B.
Solução:
1) 
2) 
3) Igualando (1) e (2) vem:
mB = 0,3 kg
44) (EFOA-MG) Um gás perfeito, a uma pressão de 10 atm, ocupa um volume de 4 litros. Ele sofre uma transformação isotérmica e seu volume atinge 10 litros. A nova pressão exercida pelo gás é de:
a) 4 atm
b) 25 atm
c) 100 atm
d) 10 atm
e) 250 atm
Solução:
p1V1 = p2V2
10 · 4 = p2 · 10
p2 = 4 atm
45) Um gás perfeito a 27 °C sofre uma expansão isotérmica de A para B, caindo sua pressão a  do valor inicial, conforme o gráfico a seguir. Determinar, para o estado B, o volume, a pressão e a temperatura do gás.
do valor inicial, conforme o gráfico a seguir. Determinar, para o estado B, o volume, a pressão e a temperatura do gás.

Resolução
pA · VA = pB · VB
20 · 10 = 4 · VB
VB = 50 l
TA = TB = 300 K = 27 °C
|





