Dessa forma, a concentração em quantidade de matéria indica a quantidade de matéria presente em um litro da solução; por isso sua unidade é mol/L.
Essa grandeza das soluções químicas também é denominada molaridade, concentração molar, ou, ainda, concentração em mol/L. Essa última expressão e a que está sendo usada no título deste texto são as formas recomendadas pela IUPAC (União Internacional da Química Pura e Aplicada) e pelo SI (Sistema Internacional de Unidades).
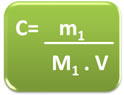
Matematicamente, temos:

- Sabendo que a fórmula da quantidade de matéria (n1) é dada por:
n1 = m1
M1
M1
Onde:
m1= massa em gramas do soluto;
M1= massa molar do soluto em gramas por mol (g/mol).
M1= massa molar do soluto em gramas por mol (g/mol).
- Substituindo n1 na fórmula da concentração em mol/L, temos:
C = n1
V
V
“Qual é a concentração em quantidade de matéria por volume de uma solução de cloreto de potássio que apresenta 18,5 g de KCl em 250 mL de solução?”
Primeiramente, para resolver esse problema, é necessário transformar o volume da solução de mililitros para litros:
1 L-----1000 mL
V ----- 250 mL
V = 0,25 L
V ----- 250 mL
V = 0,25 L
Visto que não foi dada a quantidade de matéria em mols e sim em gramas, iremos usar a segunda expressão matemática mencionada no texto e substituir nela esses valores. A massa molar do KCl é conseguida olhando-se as massas atômicas de cada elemento numa tabela periódica e somando-se os seus valores:
M1(KCl) = 39,1 + 35, 5 = 74,6 g/mol
C = __m1___
M1 . V
M1 . V
C = ___18,5 g_________
74,6 g/mol . 0,25 L
74,6 g/mol . 0,25 L
C = 1,0 mol/L
Ex 2: “Uma solução aquosa com 100 mL de volume contém 20 g de NaCl. Como proceder para expressar a concentração dessa solução em quantidade de matéria por volume?”
Resolução:
Bom, a fórmula a ser utilizada é a mesma acima, porém o volume não está em litros. Assim, devemos fazer a seguinte conversão de unidades:
1 L ------ 1000 mL
V ------ 100 mL
V = 0,1 L
V ------ 100 mL
V = 0,1 L
Também é necessário descobrir o valor da massa molar do sal NaCl. Para tal, é preciso saber os valores das massas atômicas de ambos os elementos e realizar o cálculo da massa molar ensinado no texto “Massa Molar e Número de Mol”:
M (NaCl) = 1 . 23+ 1 . 35, 46
M (NaCl) = 58,46 g/mol
Agora sim podemos substituir todos os valores na fórmula e descobrir o valor da concentração em mol/L:

1) (Fuvest-SP) A concentração de íons fluoreto em uma água de uso doméstico é de 5,0 · 10–5 mol/litro. Se uma pessoa tomar 3,0 litros dessa água por dia, ao fim de um dia, a massa de fluoreto, em miligramas, que essa pessoa ingeriu é igual a: (massa molar do fluoreto: 19,0 g/mol)
a) 0,9. b) 1,3. c) 2,8. d) 5,7. e) 15.
Resolução:
- Dados do exercício:
m1 = ? (é o que se quer encontrar)
M1= 19,0 g/mol
V (L) = 3 L
M = 5 . 10-5 mol/L
Aplicando os dados na fórmula da concentração em mol/L, temos:
M = __m1__
M1 . V(L)
M1 . V(L)
m1 = M . M1 . V(L)
m1 = 5 . 10-5 mol/L . 19,0 g/mol . 3 L
m1 = 285 . 10-5 g ou
m1 = 2,85 . 10-3 g, que é o mesmo que 2,85 mg.
Alternativa “c”
2) Uma solução de 368 g de glicerina (C3H8O3) em 1600 g de água apresenta densidade de 1,044 g/cm3. Calcule a concentração em mol/L dessa solução. Dados: massas atômicas: H = 1; C = 12; O =16.
Resolução:
A fórmula da concentração em mol/L ou molaridade (M) é:
M = __m1__
M1 . V(L)
M1 . V(L)
Onde,
m1 = massa do soluto (da glicerina);
M1= massa molar do soluto;
V (L) = volume da solução em litros.
Para usar essa fórmula, precisamos descobrir primeiro V e M1. A massa molar da glicerina é calculada normalmente:
M1(C3H8O3)= (3 . 12) + (8 . 1) + (3 . 16) = 92 g/mol
Já o volume da solução é encontrado por meio da fórmula da densidade:
d = m / v → v = m / d
A massa da solução (m) é dada pela soma da massa do soluto (glicerina) com a do solvente (água):
m = 368 g + 1600 g = 1968 g
Assim, substituindo os dados na fórmula acima, para encontrar o valor do volume, temos:
V = 1968 g / 1,044g/cm³ = 1885 cm³
Na fórmula da concentração em mol/L, o volume tem que ser dado em L, por isso fazemos a seguinte transformação:
1 L = 1dm3
1cm³ = 0,001dm³
Se dm³ = L, então:
1 cm³ --------- 0,001 L
1885 cm³ ----- V (L)
1885 cm³ ----- V (L)
V = 1,885 L
Finalmente, podemos substituir todos os valores na fórmula da concentração em mol/L e encontrá-la:
M = __m1__
M1 . V(L)
M1 . V(L)
M = ________368 g______
(92 g/mol) . (1,885 L)
(92 g/mol) . (1,885 L)
M = 2,1 mol/L
Resolução:
- Dados do exercício:
m1 = ? (é o que se quer encontrar)
M1= 98 g/mol
V (L) = 2 L
M = 3 mol/L
Aplicando os dados na fórmula da concentração em mol/L, temos:
M = __m1__
M1 . V(L)
M1 . V(L)
m1 = M . M1 . V(L)
m1 = 3 mol/L . 98 g/mol . 2 L
m1 = 588 g
4) Qual será a concentração em quantidade de matéria de uma solução que foi preparada dissolvendo-se 120 g de hidróxido de sódio em 2 L de água e obteve-se uma solução com 2 L?”
Resolução:
Dados:
m1 = 120 g
v = 2 L
MM (NaOH) = 40 g/mol
m1 = 120 g
v = 2 L
MM (NaOH) = 40 g/mol
• Substituindo os valores dados na fórmula:
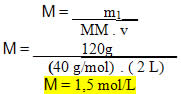
5) (USJT-SP) O ácido tartárico, C4H6O6 (conservante), usado em alguns refrigerantes, pode ser obtido a partir da uva durante o processo de fabricação do vinho.
Se a concentração
em quantidade de matéria de ácido tartárico em uma refrigerante é
0,175 mol/L, qual é a massa de ácido utilizada na fabricação de
100 000 L desse refrigerante?
a) 17 500 g.
b) 116,6 kg.
c) 0,857 t.
d) 1,75 kg.
e) 2,62 t.
Resolução:
Alternativa
"e".
Dados:
m1
=
? (é o que se quer encontrar)
MM(C4H6O6)= (4 . 12) + (6 . 1) + (6 . 16) = 150 g/mol
V (L) = 100 000 L
M = 0,175 mol/L
MM(C4H6O6)= (4 . 12) + (6 . 1) + (6 . 16) = 150 g/mol
V (L) = 100 000 L
M = 0,175 mol/L
*
Aplicando os valores relacionados na fórmula, temos:
M
=
___m1__
MM . v
MM . v
m1
=
M
.
MM . v
m1
= (0,175 mol/L) . (150 g/mol) . (100 000 L)
m1
=
2625000
g
= 2625 . 106
g
=
2,62 t
6) (VUNESP-2000) Sabendo-se que a massa molar do lítio é 7,0g/mol, a massa de lítio contida em 250mL de uma solução aquosa de concentração 0,160mol/L de carbonato de lítio é:
a) 0,560g.
b) 0,400g.
c) 0,280g.
d) 0,160g.
e) 0,080g.
Resolução:
C = n / V
C = m /
(M.V)
m = C.M.V
m =
0,160.67.0,250
m = 2,68
g
67 g de
Li2CO3 ---------------- 2.7 g de Li
2,68 g de
Li2CO3 ------------- x
x =
2,68.2.7 / 67
x = 0,560
g. Alternativa "a".
7) 10,00 mL de uma solução de (NH4)2SO4 foram tratados com excesso de NaOH. O gás NH3 liberado foi absorvido em 50,00 mL de uma solução 0,10 mol.L-1 de HCℓ. O HCℓ que sobrou foi neutralizado por 21,50 mL de uma solução 0,10 mol.L-1 de NaOH. Qual a concentração da solução de (NH4)2SO4 em mol.L-1?
a) 0,28
b) 0,14
c) 0,32
d) 0,42
e) 0,50
8) (PUC-RIO 2008) É possível conhecer a concentração de uma espécie iônica em solução aquosa, a partir do conhecimento da concentração de soluto e se o soluto dissolvido dissocia-se ou ioniza-se por completo. Uma solução de sulfato de sódio, Na2SO4 possui concentração em quantidade de matéria igual 0,3 mol L−1. Nessa solução, a concentração, em quantidade de matéria, da espécie Na+ é:
a) 0,2 mol L-1
b) 0,3 mol L-1
c) 0,6 mol L-1
d) 0,8 mol L-1
e) 0,9 mol L-1
10) Uma solução de ácido clorídrico a 10% em massa tem densidade 1,05 g/mL.Qual a concentração dessa solução em g/L ? C=105 g/l
11) Que volume de uma solução 0,778 mol/L Na2CO3 deveria ser diluído até 150 mL com água para reduzir sua concentração a 0,234 mol/L? v= 4,51 mL
Gente, muito boa a explicação... Mas gostaríamos que vcs postassem as fórmulas para resolver os problemas, mas só as fórmulas, para ficar mais fácil de entender... Muito obrigado !!
ResponderExcluir