Na natureza, todos os sistemas tendem a adquirir a maior estabilidade possível. Os átomos ligam-se uns aos outros para aumentar a sua estabilidade. Os gases nobres são as únicas substâncias formadas por átomos isolados.
Conclusão: os átomos dos gases nobres são os únicos estáveis.
Os átomos dos gases nobres são os únicos que possuem a camada da valência completa, isto é, com oito elétrons (ou dois, no caso da camada K).
Conclusão: a saturação da camada da valência com oito elétrons (ou dois, no caso da camada K) aumenta a estabilidade do átomo.
A configuração eletrônica com a camada da valência completa é chamada configuração estável. Os átomos dos gases nobres são os únicos que já têm a camada da valência completa.
Teoria do octeto
Ligações Químicas
Surgiu com a associação entre estabilidade dos gases nobres e o fato de possuíram 8 elétrons na última camada.
Para atingir uma situação estável, os átomos tendem a buscar uma estrutura eletrônica cuja camada de valência contenha 8 elétrons igual ao gás nobre que tenha o número atômico mais próximo.
Os átomos menores em número de elétrons tendem a alcançar o dueto, ou seja, procuram conseguir dois elétrons na camada de valência como o hélio: (Z = 2), logo 1s2. É o caso do hidrogênio e do lítio.
Por ser a última camada, quando dois átomos se encontram a camada de valência de um toca a camada de valência do outro. A observação dos átomos já conhecidos, permite estabelecer algumas regras para a ligação eletrônica:
1º quando um átomo tiver 8 elétrons na camada de valência, existira uma “estabilidade” e ele não se ligará a outros átomos. Por isso não se pode formar nenhum composto químico com os gases nobres hélio (He); neônio (Ne); argônio (Ar); criptônio (Kr); xenônio (Xe); e randônio (Rn).2º Quando um átomo possuir menos de 8 elétrons na camada de valência, ele tende a “associar-se” a outros átomos para completar ou eliminar a camada incompleta.3º Com 1, 2 ou 3 elétrons na última camada, o átomo procura eliminar.4º Com 5, 6, 7 elétrons na camada de valência, a tendência é completar.5º Com 4 elétrons na última camada, tanto faz eliminar ou completar, dependerá do elemento químico em questão.Existe, então, uma regra prática para verificar a distribuição eletrônica de um átomo. No entanto, é importante saber que essa regra tem muitas exceções.
Levando-se em conta a representação universal das camadas (K L M N O P Q), distribui-se os elétrons do elemento químico, levando-se em conta a quantidade máxima de elétrons em cada camada, até chegar à camada de valência do elemento em questão.
Observe
Lembrando mais uma vez que o número atômico Z = nº de prótons, e que um átomo neutro possui nº de prótons = nº de elétrons, para um elemento cujo nº atômico é 20 (Z = 20) temos a seguinte representação:
Nº máximo
de e- | 2 | 8 | 18 | 32 | 32 | 18 | 2 |
| Camadas | K | L | M | N | O | P | Q |
| 20 Ca (Z=20) | 2 |
8
| ? |
?
|
Colocando 2 na 1ª camada; mais 8 na segunda, na terceira camada, onde cabe 18 elétrons, você poderia colocar 10, dessa forma completaria a quantidade de elétrons que os átomos do cálcio possuem. No entanto, na última camada cabem apenas 8 elétrons. Se isso bastasse, talvez você pudesse escrever assim:
Nº máximo
de e- | 2 | 8 | 18 | 32 | 32 | 18 | 2 |
| Camadas | K | L | M | N | O | P | Q |
| 20 Ca (Z=20) | 2 |
8
| 9 |
1
|
No entanto, o mínimo de elétrons que pode ter em uma camada é 2, sendo assim, o correto no caso do cálcio (20Ca) é escrever:
Nº máximo
de e- | 2 | 8 | 18 | 32 | 32 | 18 | 2 |
| Camadas | K | L | M | N | O | P | Q |
| 20 Ca (Z=20) | 2 |
8
| 8 | 2 |
Ligações Químicas
Ligação iônica ou eletrovalente é a atração eletrostática entre íons de cargas opostas num retículo cristalino. Esses íons formam-se pela transferência de elétrons dos átomos de um elemento para os átomos de outro elemento.
Para se formar uma ligação iônica, é necessário que os átomos de um dos elementos tenham tendência a ceder elétrons e os átomos do outro elemento tenham tendência a receber elétrons.
Para se formar uma ligação iônica, é necessário que os átomos de um dos elementos tenham tendência a ceder elétrons e os átomos do outro elemento tenham tendência a receber elétrons.
Quando os átomos de dois elementos A e B têm ambos tendência a ceder ou a receber elétrons, não pode se formar uma ligação iônica entre eles.
Os átomos com tendência a ceder elétrons apresentam um, dois ou três elétrons na camada da valência; são todos átomos de metais, com exceção dos átomos de H e He. Os átomos com tendência a receber elétrons apresentam quatro, cinco, seis e sete elétrons na camada da valência; são os átomos dos não-metais e do H.
Uma ligação iônica forma-se entre um metal e um não-metal ou entre um metal e o H. Os elétrons são transferidos dos átomos dos metais para os dos não-metais ou do H.
Os átomos dos metais, cedendo elétrons, transformam-se em íons positivos ou cátions, e os átomos dos não-metais ou do H, recebendo elétrons, transformam-se em íons negativos ou ânions.
Todo ânion monoatômico tem configuração estável, semelhante à de um gás nobre, porque, na formação do ânion, o átomo recebe exatamente o número de elétrons que falta para ser atingida a configuração estável.
Nem todo cátion monoatômico tem configuração estável. O átomo, ao ceder os elétrons de sua camada da valência , nem sempre fica com configuração estável.
Os cátions dos metais alcalinos e alcalino-terrosos, bem como o cátion de alumínio, têm configurações estáveis. Os cátions dos metais de transição não têm, em sua maioria, configuração estável.
Exemplo: A configuração eletrônica do Sódio e do Cloro segundo o diagrama de Linus Pauling fica do seguinte modo:
11Na 1s2 2s2 2p6 3s1
17Cl 1s2 2s2 2p6 3s2 3p5
O sódio possui 1 elétron na última camada. Basta perder este elétron para que ele fique estável com 8 elétrons na 2ª camada.
O cloro possui 7 elétrons na última camada. É bem mais fácil ele receber 1 elétron e ficar estável do que perder 7 elétrons para ficar estável, sendo isto o que acontece.
Agora tudo está perfeito. O sódio quer doar 1 elétron e o cloro quer receber 1 elétron. Eles se aproximam e o sódio doa seu elétron que está em excesso e o cloro o recebe.
Veja o esquema abaixo:

Valência É o número de ligações que um átomo precisa fazer para adquirir uma configuração estável, como a configuração de um gás nobre.
Com exceção do hélio, os gases nobres (listados na coluna 8ª da Tabela Periódica) apresentam oito elétrons na camada de valência, observe:
| K | L | M | N | O | P | Q | ||
| He | (Z = 2) | 2 | ||||||
| Ne | (Z = 10) | 2 | 8 | |||||
| Ar | (Z = 18) | 2 | 8 | 18 | 8 | |||
| Kr | (Z = 36) | 2 | 8 | 18 | 18 | 8 | ||
| Xe | (Z = 54) | 2 | 8 | 18 | 32 | 18 | 8 | |
| Rn | (z = 86) | 2 | 8 | 18 | 32 | 32 | 18 | 8 |
Eletrovalência é a valência do elemento na forma iônica. É igual à carga do seu íon monoatômico.
Ligação covalente ou molecular É aquela onde os átomos possuem a tendência de compartilhar os elétrons de sua camada de valência, ou seja, de sua camada mais instável. Neste tipo de ligação não há a formação de íons, pois as estruturas formadas são eletronicamente neutras.

Note que há o compartilhamento de elétrons entre os átomos de hidrogênio e os de oxigênio. Os elétrons da nuvem eletrônica não pertencem exclusivamente ao hidrogênio nem ao oxigênio; pertencem aos dois átomos simultaneamente.~
A ligação covalente pode ser: simples, dupla ou tripla de acordo com o nº de pares de electrões compartilhados.
A ligação covalente pode ser: simples, dupla ou tripla de acordo com o nº de pares de electrões compartilhados.
- Ligação covalente simples: ligação química onde participa um par de elétrons Simboliza-se por um traço entre os átomos ligados. Por exemplo H-H.
- Ligação covalente dupla: ligação química onde participa dois pares de elétrons Simboliza-se por dois traços entre os átomos ligados. Por exemplo O=O.
- Ligação covalente tripla: ligação química onde participa três pares de eléctrons Simboliza-se por três traços entre os átomos ligados. Por exemplo N≡N.
Ligação dativa ou coordenada Este tipo de ligação ocorre quando os átomos envolvidos já atingiram a estabilidade com os oito ou dois elétrons na camada de valência.

Note que as setas vermelhas indicam as ligações dativas; onde o átomo de enxofre "doa" um par de elétrons para cada átomo de oxigênio; e os traços indicam o compartilhamento de elétrons que ocorre normalmente entre o enxofre e o oxigênio.
Ligação metálica é constituída pelos elétrons livres que ficam entre os cátions dos metais (modelo do gás eletrônico ou do mar de elétrons). Os metais são constituídos por seus cátions mergulhados em um mar de elétrons.
A ligação metálica explica a condutividade elétrica, a maleabilidade, a ductilidade e outras propriedades dos metais.
Eletronegatividade de um elemento é uma medida da sua capacidade de atrair os elétrons das ligações covalentes das quais ele participa.
Quanto maior for a capacidade de um átomo de atrair os elétrons das ligações covalentes das quais ele participa, maior será a sua eletronegatividade.
Ligação covalente polar é aquela que constitui um dipolo elétrico. Forma-se quando as eletronegatividades dos elementos ligados são diferentes.
Ligação covalente apolar é aquela que não constitui dipolo elétrico. Neste caso, as eletronegatividades dos átomos ligados são iguais.
Tipos de substâncias
Substância iônica ou eletrovalente é toda substância que apresenta pelo menos uma ligação iônica. Mesmo as substâncias que apresentam ligações iônicas e covalentes são classificadas como iônicas.
Substância molecular apresenta somente ligações covalentes e é formada por moléculas discretas.
Substância covalente apresenta somente ligações covalentes e é formada por macromoléculas.
| Propriedade das substâncias iônicas |
|---|
| Alto ponto de fusão (PF) e ponto de ebulição (PE). |
| Sólidas à temperatura ambiente. |
| Conduzem a corrente elétrica no estado fundido e não no estado sólido. |
| Cristais duros e quebradiços. |
As substâncias moleculares não apresentam as propriedades acima. As substâncias covalentes, ao contrário das moleculares, têm PF e PE altíssimos (analogia com as iônicas).
Fórmulas eletrônicas e estruturais
Estruturas de Lewis ou fórmulas eletrônicas são representações dos pares de elétrons das ligações covalentes entre todos os átomos da molécula, bem como dos elétrons das camadas da valência que não participam das ligações covalentes.
Estruturas de Couper ou fórmulas estruturais planas são representações, por traços de união, de todas as ligações covalentes entre todos os átomos da molécula.
Simples ligação é uma ligação covalente entre dois átomos (A - B).
Ligação dupla são duas ligações covalentes entre dois átomos (A = B).
Ligação tripla são três ligações covalentes entre dois átomos (A º B).
Fontes: www.geocities.com
www.mundoeducação.com.br
Exercícios sobre ligações químicas
a) NaCl
b) KI
c) MgSO4
d) MgCl
e) Na2SO4
2) (FEI – SP) Um elemento X, pertencente à família (2A) da tabela periódica, forma ligação química com outro elemento Y da família (7A). Sabendo-se que X não é o Berílio, qual a fórmula do composto formado e o tipo de ligação entre X e Y?
3) (U.F. Uberlândia) Na reação de um metal A com um elemento B, obteve-se uma substância de fórmula A2B. O elemento B provavelmente é um:
a) Halogênio
b) Metal de transição
c) Metal Nobre
d) Gás raro
e) Calcogênio
4) (UCMG) Um elemento químico A de número atômico 16, combina-se com um elemento B, de número atômico 17. A fórmula molecular do composto e o tipo da ligação são:
a) AB2 - covalente
b) A2B - molecular
c) AB2 – eletrovalente ou iônica
d) AB – eletrovalente ou iônica
e) A2B – eletrovalente ou iônica
5) No cianeto de sódio (NaCN) existem:
a) somente ligações iônicas.
b) somente ligações covalentes.
c) somente ligações metálicas.
d) ligações iônicas e covalentes.
e) ligações metálicas e covalentes.
6) O aumento de diferença de eletronegatividade entre os elementos ocasiona a seguinte ordem no caráter das ligações
a) covalente polar, covalente apolar, iônica.
b) iônica, covalente polar, covalente apolar.
c) covalente apolar, iônica, covalente polar.
d) covalente apolar, covalente polar, iônica.
e) iônica, covalente apolar, covalente polar.
7) (FUC – MT) A ligação covalente de maior polaridade ocorre entre H e átomos de:
a) F
b) Cl
c) Br
d) I
e) At
8) (UFRS) “Para a formação da ligação, duas condições são necessárias: um par de elétrons com spins opostos e um orbital estável em cada átomo. A força de ligação é qualitativamente proporcional à interpenetração das nuvens de carga dos dois átomos.”
O texto refere-se à ligação:
a) iônica
b) metálica
c) covalente
d) por forças de Van der Waals
e) por pontes de hidrogênio.
9) (UFV/2011) É correto afirmar que o ácido acético (CH3CO2H) é capaz de realizar ligação de hidrogênio com moléculas de:
a) éter dietílico.
b) benzeno.
c) cicloexano.
d) 1,2-dietilbenzeno.
10) O cloreto de sódio (NaCl), o pentano (C5H12) e álcool comum (CH3 CH2OH) têm suas estruturas constituídas , respectivamente, por ligações:
a) iônicas, covalentes e covalentes
b) covalentes, covalentes e covalentes
c) iônicas, covalentes e iônicas
d) covalentes, iônicas e iônicas
e) iônicas, iônicas e iônicas
11) (FUVEST-SP) Considere o elemento cloro formando compostos com, respectivamente, hidrogênio, carbono, sódio e cálcio. (Consulte a tabela periódica.). Com quais desses elementos o cloro forma compostos covalentes?
12) (UNI-RIO) O dióxido de carbono (CO2) é um gás essencial no globo terrestre. Sem a presença desse gás, o globo seria gelado e vazio. Porém, quando ele é inalado em concentração superior a 10%, pode levar o indivíduo à morte por asfixia. Esse gás apresenta em sua molécula um número de ligações covalentes igual a:
a) 4
b) 1
c) 2
d) 3
e) 0
13) (FUVEST) As unidades constituintes dos sólidos: óxido de magnésio (MgO), iodo (I2) e platina (Pt) são, respectivamente:
a) átomos, íons e moléculas;
b) íons, átomos e moléculas;
c) íons, moléculas e átomos
d) moléculas, átomos e íons;
e) moléculas, íons e átomos.
1) a) NaCl - Cloreto de sódio b) KI - Iodeto de potássio c) MgSO4 - Sulfato de magnésio
d) MgCl - Cloreto de magnésio e) Na2SO4 - Sulfato de sódio
2) O elemento X é Magnésio e o Y é Cloro. O composto formado pela ligação entre um metal com um ametal é iônico, portanto a ligação entre X e Y deve ser iônica. A fórmula para o composto é Mg+Cl2- e a nomenclatura: Cloreto de magnésio.
3) C 4) C 5) D 6) D 7) A 8) C 9) A questão aborda de forma simples um tipo de interação intermolecular, chamado ligação de hidrogênio. O estudante precisava lembrar que a ligação de hidrogênio é formada com um átomo de hidrogênio ligado a um elemento muito eletronegativo como oxigênio (O), flúor (F) ou nitrogênio (N), e outro, também bastante eletronegativo, que possui pelo menos um par de elétons não ligantes, como O, N ou F.
Uma vez que todas as alternativas, com exceção da letra A, apresenta exemplos de hidrocarbonetos, a resposta é a alternativa A. A ligação de hidrogênio vai ocorrer via o par de elétrons não ligantes do oxigênio da molécula de éter.
Resposta: A
10) Cloreto de sódio → ligação iônica: Na+Cl-
Pentano → ligação covalente entre átomos de carbono e hidrogênios.
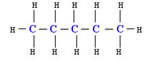
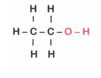
Álcool comum → ligação covalente entre carbonos, oxigênio e hidrogênios.
11) Hidrogênio e carbono.
Os compostos covalentes se formam através da união entre átomos de hidrogênio, ametais ou semimetais. O cloro (Cl) se classifica na Tabela Periódica como sendo um ametal, como também o carbono (C). Tanto o sódio (Na) como o cálcio (Ca) são metais e por isso não estabelecem ligação covalente com o cloro.
12) O carbono, membro da família IV A, pode compartilhar 4 elétrons para formar ligações.
- O oxigênio pertence à família VI A, portanto possui 6 elétrons na camada de valência, podendo compartilhar 2 desses elétrons para formar ligações covalentes.
O ═ C ═ O
Cada ligação dupla representa duas ligações covalentes, como são duas ligações ═, temos no total 4 ligações covalentes.
13) C
As respostas onde estão????
ResponderExcluirFoi mal achei já!! obrigada e adorei o blog.
ResponderExcluirO gabarito da 4 esta errado! A resposta é a alternativa a). Nao tem como uma ligação entre dois ametais ser ionica!
ResponderExcluirvc tem razao foi a mesma coisa que eu percebi
ExcluirO Gabarito da 3ª está errado.
ResponderExcluir3) (U.F. Uberlândia) Na reação de um metal A com um elemento B, obteve-se uma substância de fórmula A2B. O elemento B provavelmente é um:
a) Halogênio
b) Metal de transição
c) Metal Nobre
d) Gás raro
e) Calcogênio
a) Halogênio --> não pode ser, já que a valência deles de -1 não necessitaria de 2 átomos do metal.
b) Metal de Transição --> Os metais quando ligados a outros metais formam substâncias metálicas.
c) Metais Nobres --> São elementos de transição, pode se usar a mesma expllicação da letra B. Sem dizer que se esta alternativa estivesse certa, a B também estaria certa, logo que os metais nobres são metais de transição.
d) Gás raro --> ( ?! ) essa é a primeira a ser excluida.
e) Calcogênios. --> Essa, na minha opinião, é a correta.
A --> Considerar um metal alcalino-terroso. Ex:. Li, K, Na. Valência=+1
B --> Calcogênio. Ex:. O, S, Se. Valência= - 2
Eles pedem um que tenha A2B.
Ex:. Li2O (Oxído de Lítio) , K2O (Oxído de Potássio), Na2O (Oxíd...).
Concordo com você,pois os calcogênios precisam ser ânions bivalentes para se estabilizar segundo a regra do octeto!
ExcluirLOUCURA!
ResponderExcluir