As propriedades periódicas são tendências ou características que alguns elementos tem e que marca sua localização na tabela periódica.
Os elementos químicos são organizados de acordo com suas propriedades periódicas e tais propriedades são alteradas de acordo com o número atômico. As principais propriedades periódicas são: Raio atômico, Energia de Ionização, Afinidade eletrônica, Eletronegatividade, Eletropositividade e Potencial de Ionização.
Os elementos químicos são organizados de acordo com suas propriedades periódicas e tais propriedades são alteradas de acordo com o número atômico. As principais propriedades periódicas são: Raio atômico, Energia de Ionização, Afinidade eletrônica, Eletronegatividade, Eletropositividade e Potencial de Ionização.
Raio atômico
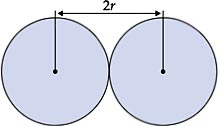
O raio atômico se refere ao tamanho do átomo. Quanto maior o número de níveis, maior será o tamanho do átomo. O átomo que possui o maior número de prótons exerce maior atração sobre seus elétrons.
Em outras palavras, raio atômico é a distância do núcleo de um átomo à sua eletrosfera na camada mais externa. Porém, como o átomo não é rígido, calcula-se o raio atômico médio pela metade da distância entre os centros dos núcleos de dois átomos de mesmo elemento numa ligação química em estado sólido.
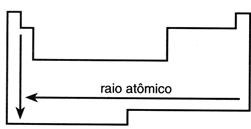
O raio atômico cresce de cima para baixo na família da tabela periódica, acompanhando o número de camadas dos átomos de cada elemento e da direita para a esquerda nos períodos da tabela periódica.
Quanto maior o número atômico de um elemento no período, maiores são as forças exercidas entre o núcleo e a eletrosfera, o que resulta num menor raio atômico.
O elemento de maior raio atômico é o Césio.
Energia de Ionização
Energia de Ionização é a energia necessária para remover um ou mais elétrons de um átomo isolado no estado gasoso. O tamanho do átomo interfere na sua energia de ionização. Se o átomo for grande, sua energia de ionização será menor.
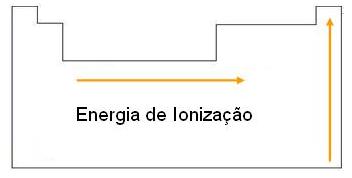
- Em uma mesma família a energia aumenta de baixo para cima;
- Em um mesmo período a Energia de Ionização aumenta da esquerda para a direita.
- Em um mesmo período a Energia de Ionização aumenta da esquerda para a direita.
Afinidade eletrônica
Afinidade eletrônica é a energia liberada quando um átomo no estado gasoso (isolado) captura um elétron. Quanto menor o raio, maior a sua afinidade eletrônica, em uma família ou período.
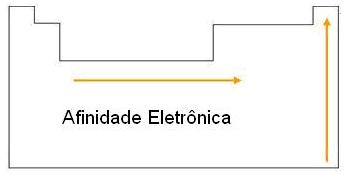
A afinidade eletrônica mede a energia liberada por um átomo em estado fundamental e no estado gasoso ao receber um elétron. Trata-se da energia mínima necessária para a retirada de um elétron de um ânion de um determinado elemento.
Nos gases nobres a afinidade eletrônica não é significativa, porém como a adição de um elétron em qualquer elemento causa liberação de energia, então a afinidade eletrônica dos gases nobres não é igual a zero.
O elemento químico que possui a maior afinidade eletrônica é o Cloro.
Eletronegatividade
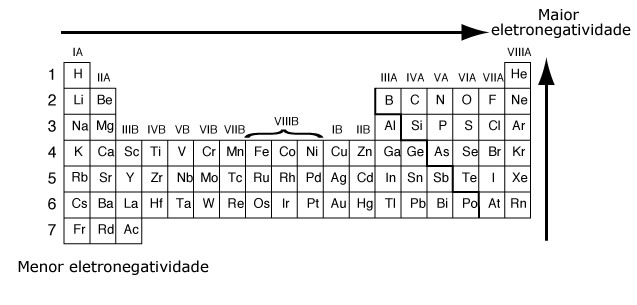
A Eletronegatividade é a força de atração exercida sobre os elétrons de uma ligação. Na tabela periódica a eletronegatividade aumenta de baixo para cima e da esquerda para a direita.
Essa propriedade tem relação com o raio atômico: quanto menor o tamanho de um átomo, maior é a força de atração sobre os elétrons.
Não é possível calcular a eletronegatividade de um único átomo (isolado), pois a eletronegatividade é a tendência que um átomo tem em receber elétrons em uma ligação covalente. Portanto, é preciso das ligações químicas para medir essa propriedade.
Segundo a escala de Pauling*, a eletronegatividade cresce na família de baixo para cima, junto com à diminuição do raio atômico e do aumento das interações do núcleo com a eletrosfera e no período da esquerda pela direita, acompanhando o aumento do número atômico.
O elemento mais eletronegativo da tabela periódica é o flúor.
*A escala de Pauling é uma escala construída empiricamente e muito utilizada na Química. Ela mede a atração que o átomo exerce sobre elétrons externos em ligações covalentes, ou seja, sua eletronegatividade.
Eletropositividade
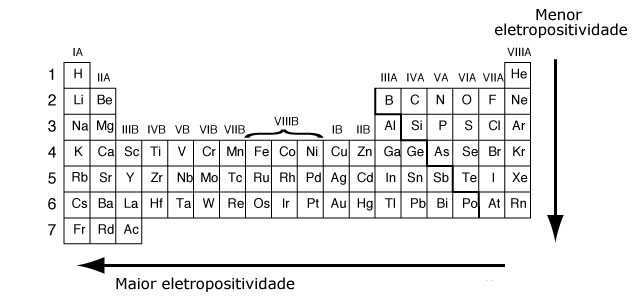
Eletropositividade é a tendência de perder elétrons, apresentada por um átomo. Quanto maior for seu valor, maior será o caráter metálico. Os átomos com menos de quatro elétrons de valência, metais em geral, possuem maior tendência em perder elétrons, por isso, possuem maior eletropositivade. Um aumento no número de camadas diminui a força de atração do núcleo sobre os elétrons periféricos, facilitando a perda de elétrons pelo átomo e, consequentemente, aumentando a sua eletropositividade.
A eletropositividade cresce da direita para a esquerda nos períodos e de cima para baixo nas famílias.
A forma da medir a eletropositividade de um elemento é a mesma da eletronegatividade: através das ligação química. Entretanto, o sentido é o contrário, pois mede a tendência de um átomo em perder elétrons. Os metais são os mais eletropositivos e os gases nobres são excluídos¹, pois não têm tendência em perder elétrons.
O elemento químico mais eletropositivo é o frâncio. Ele tem tendência máxima à oxidação.
¹Como os gases nobres são muito inertes, os valores de eletronegatividade e eletropositividade não são objetos de estudo pela dificuldade da obtenção desses dados.
Potencial de Ionização
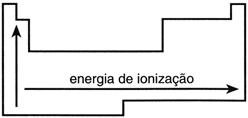
O Potencial de Ionização mede o contrário da afinidade eletrônica: a energia necessária para retirar um elétron de um átomo neutro, em estado fundamental e no estado gasoso. A retirada de elétron na primeira vez utilizará uma quantidade de energia maior que na segunda retirada e assim sucessivamente.
Possui comportamento igual ao da afinidade eletrônica e da eletronegatividade, portanto, o Flúor e o Cloro são os elementos que possuem os maiores potenciais de ionização da tabela periódica.



REATIVIDADE
A reatividade de um elemento químico está associada à sua maior ou menor facilidade em ganhar ou perder elétrons. Assim, os elementos mais reativos serão tantos os metais que perdem elétrons com maior facilidade, quanto os ametais que ganham elétrons com maior facilidade.

Pela figura podemos observar que:
a) entre os metais, o mais reativo é o frâncio (Fr)
b) entre os ametais, o mais reativo é o flúor (F).
PROPRIEDADE FÍSICAS DOS ELEMENTOS
As propriedades físicas são determinadas experimentalmente, mas, em função dos dados obtidos, podemos estabelecer regras genéricas para sua variação, considerando a posição do elemento na tabela periódica.
DENSIDADE
Num período:
A densidade cresce das extremidades para o centro
Numa família:
A densidade cresce de cima para baixo.
Esquematicamente, podemos representar por:

Assim, os elementos de maior densidade estão situados na parte central e inferior da tabela, sendo o Ósmio (Os) o elemento mais denso (22,5 g/cm3).
*** A tabela apresenta densidade obtida a 0 C e 1 atm.
PONTO DE FUSÃO (PF) e PONTO DE EBULIÇÃO (PE)
PONTO DE FUSÃO: É temperatura na qual uma substância passa do estado sólido para o estado líquido.
PONTO DE EBULIÇÃO: É temperatura na qual uma substância passa do estado líquido para o estado gasoso.
Na família IA (alcalinos) e na família IIA (alcalinos terrosos), IIB, 3A, 4A, os elementos de maior ponto de fusão (PF) e ponto de ebulição (PE) estão situados na parte superior da tabela.
De modo inverso, nas demais famílias, os elementos com maiores PF e PE estão situados na parte inferior.
Nos períodos, de maneira geral, os PF e PE crescem da extremidades para o centro da tabela.
Esquematicamente podemos representar por:

Entre os metais o tungstênio (W) é o que apresenta o maior PF: 5900 ° C. Uma anomalia importante ocorre com o elemento químico carbono (C),um ametal: Ele tem uma propriedade de originar estruturas formadas por um grande número de átomos, o que faz com que esse elemento apresente elevados pontos de fusão ( PF =3550 ° C)
Fonte: http://www.tabelaperiodicacompleta.com/propriedades-periodicas
www.geocities.com
Exercícios sobre propriedades periódicas dos elementos
1) (ITA-SP) Qual das opções abaixo apresenta a comparação errada relativa aos raios de átomos e de íons?
a) raio do Na+ < raio do Na
b) raio do Na+ < raio do F-
c) raio do Mg2+ < raio do O2-
d) raio do F- < raio do O2-
e) raio do F- < raio do Mg2+
7) Um determinado elemento químico esta situado no quarto período da tabela periódica e pertence a família 6A. Sobre este elemento afirma-se:
a) Tem seis elétrons em sua ultima camada.
b) Apresenta três camadas eletrônicas.
c) É um calcogênio.
d) Possui baixa eletronegatividade.
e)Pertence a mesma família do oxigênio.
www.geocities.com
Exercícios sobre propriedades periódicas dos elementos
1) (ITA-SP) Qual das opções abaixo apresenta a comparação errada relativa aos raios de átomos e de íons?
a) raio do Na+ < raio do Na
b) raio do Na+ < raio do F-
c) raio do Mg2+ < raio do O2-
d) raio do F- < raio do O2-
e) raio do F- < raio do Mg2+
2) (PUC-MG) Os elementos que apresentam maiores energias de ionização são da família dos:
a) metais alcalino-terrosos.
b) gases nobres.
c) halogênios.
d) metais alcalinos.
3) (PUC-RS) Com relação à classificação periódica dos elementos, pode-se afirmar que o:
a) hidrogênio é um metal alcalino localizado na 1ª coluna.
b) nitrogênio é o elemento mais eletropositivo da 15ª coluna.
c) sódio é o elemento mais eletronegativo do 3° período.
d) mercúrio é um ametal líquido à temperatura ambiente.
e) potássio tem maior raio atômico que o Br.
4) (UFF-RJ) Dois ou mais íons ou, então, um átomo e um íon que apresentam o mesmo número de elétrons denominam-se espécies isoeletrônicas.
Comparando-se as espécies isoeletrônicas F-, Na+, Mg2+, e Al3+, conclui-se que:
a) a espécie Mg2+ apresenta o menor raio iônico.
b) a espécie Na+ apresenta o menor raio iônico.
c) a espécie F- apresenta o maior raio iônico.
d) a espécie Al3+ apresenta o maior raio iônico.
e) a espécie Na+ apresenta o maior raio iônico.
5) (UDESC 2010) A adsorção de íons é um dos fenômenos mais importantes na química do solo, pois é o principal atributo que afeta a concentração da maioria dos minerais na solução do solo. Dentre as propriedades físico-químicas, como eletronegatividade e polaridade, o tamanho do átomo apresenta influência direta na adsorção dos elementos.
K, Ca, Mn, Fe e Zn
Assinale a alternativa correta em relação à sequência dos elementos descritos acima.
a) O Zn é o maior elemento descrito na sequência acima, pois apresenta o maior número atômico.
b) O K é o menor elemento descrito na sequência acima, pois se encontra na família 1 A.
c) O Ca é o menor elemento descrito na sequência acima, pois apresenta número de oxidação 2+.
d) Os elementos estão ordenados em ordem crescente de raio atômico.
e) Os elementos estão ordenados em ordem decrescente de raio atômico.
6) (UFF 2010) Após os trabalhos de Lavoisier, Dalton e outros, o estudo dos elementos químicos desenvolveu-se de tal forma que se tornou necessário classificá-los de acordo com suas propriedades. A observação experimental tornou evidente que certos elementos têm propriedades muito semelhantes, o que permite reuni-los em grupos. Desde o século XIX, várias tentativas foram feitas, sem grande sucesso. O trabalho mais detalhado foi feito em 1869 por Mendeleev. Ele ordenou os elementos em função de suas massas atômicas crescentes, respeitando suas propriedades químicas. O trabalho foi tão importante que ele chegou a prever a existência de elementos que ainda não haviam sido descobertos. Com base na tabela periódica, pode-se constatar que:
a) a energia de ionização de um elemento é a energia máxima necessária para remover um elétron do átomo desse elemento no estado gasoso.
b) os elementos de transição interna são aqueles cujo subnível de maior energia da distribuição eletrônica de seus átomos é f.
c) a afinidade eletrônica ou eletroafinidade é a energia associada à saída de um elétron num átomo do elemento no estado gasoso.
d) as propriedades dos elementos são funções aperiódicas de seus números atômicos.
e) os elementos representativos são os elementos cujo subnível de menor energia da distribuição eletrônica de seus átomos é s ou p.
7) Um determinado elemento químico esta situado no quarto período da tabela periódica e pertence a família 6A. Sobre este elemento afirma-se:
a) Tem seis elétrons em sua ultima camada.
b) Apresenta três camadas eletrônicas.
c) É um calcogênio.
d) Possui baixa eletronegatividade.
e)Pertence a mesma família do oxigênio.
8) O elemento químico flúor, de numero atômico 9, possui:
a) Alta eletronegatividade.b) Baixo potencial de ionização.
c) Ponto de fusão grande.
d) Características metálicas.
e) Grande facilidade de conduzir a corrente elétrica.
9) Assinale a alternativa que indica corretamente a ordem crescente dos raios atômicos:
1) Letra E. O raio do íon negativo F-(ânion) é maior que o raio do íon positivo Mg2+ (cátion).
2) Letra B. Em um mesmo período a energia de ionização (E.I.) aumenta da esquerda para a direita. Como a família dos Gases Nobres se localiza na extremidade mais à direita da tabela, corresponde aos elementos que apresentam maior energia de ionização.
3) Alternativa E. O Potássio (K) e o Bromo (Br) se localizam no mesmo período, só que em lados opostos: K na extremidade esquerda da tabela e Br na extremidade direita. Em um mesmo período, o raio atômico aumenta da direita para a esquerda na tabela.
a) (INCORRETA) hidrogênio não é um metal alcalino, é um gás.
b) (INCORRETA) nitrogênio é o elemento mais eletronegativo da 15ª coluna.
c) (INCORRETA) sódio é o elemento mais eletropositivo do 3° período.
d) (INCORRETA) mercúrio é um METAL líquido à temperatura ambiente.
4) Alternativa C. F- apresenta o maior raio iônico, ou energia de ionização. Quanto menor o tamanho do átomo, maior será o raio iônico.
5) E
6) B
7) A) Alternativa verdadeira. Os calcogênios possuem seis elétrons na camada de valência.
B) Alternativa falsa. Se o elemento encontra-se no quarto período, ele possui quatro camadas eletrônicas.
C) Alternativa verdadeira.
D) Alternativa falsa. Possui alta eletronegatividade, uma vez que a eletronegatividade cresce para a direita.
E) Alternativa verdadeira. O oxigênio pertence à família 6A e é também, portanto, um calcogênio.
8) A) Alternativa verdadeira. É o elemento de maior eletronegatividade da tabela.
B) Alternativa falsa. Apresenta alto potencial de ionização, visto que se encontra à direita na tabela.
C) Alternativa falsa. O ponto de fusão do flúor não é elevado: ele é um ametal.
D) Alternativa falsa. O flúor é um ametal e não pode, portanto, apresentar características metálicas.
E) Alternativa falsa. É um ametal e, como substância simples diatômica, é um composto molecular e, por isso, não conduz muito bem corrente elétrica.
a) Cs < Rb < K < Na < li.
b) Cs < Li < Rb < Na < K.
c) K < Rb < Na < Cs < Li
d) Li < Cs < Na < Rb < K.
e) Li < Na < K < Rb < Cs.
10) Comparando o cloro e o sódio, os dois elementos químicos formados do sal de cozinha, pode-se afirmar que o cloro:
a)É mais denso.
b)É menos volátil.
c)Tem maior caráter metálico.
d)Tem menor energia de ionização.
e)Tem menor raio atômico.
11) (U.F. VIÇOSA) A afirmativa falsa, referente à eletronegatividade, é:
a) A diferença entre as eletronegatividades de dois elementos determina a predominância do caráter iônico ou de covalência das ligações entre seus átomos.
b) A eletronegatividade dos elementos de um mesmo grupo de classificação periódica varia diretamente em seus raios atômicos.
c) A eletronegatividade dos elementos de um mesmo período da classificação periódica varia diretamente com carga nuclear.
d) O flúor é o elemento mais eletronegativo dos halogênios.
e) Os elementos de menor eletronegatividade são os metais alcalinos.
12) (CATANDUVA) Qual das partículas abaixo possui maior raio?
Números atômicos: Cl (17); K (19); Ca (20); S (16), Ar (18)
a) Cl-
b) K+
c) Ca2+
d) S2-
e) Ar
13) (FUVEST) Considere as substâncias:
I. argônio
II. diamante
III. cloreto de sódio
IV. água
Dentre elas, apresentam ligações covalentes apenas:
a) I e II
b) I e III
c) II e III
d) II e IV
e) III e IV
14) (CESGRANRIO) Identifique, entre os compostos mencionados abaixo, o composto iônico:
a) BCl3
b) Icl
c) CsCl
d) HCl
e) Cl2
15) (FUVEST) Na tabela periódica, os elementos químicos estão ordenados:
a) Segundo seus volumes atômicos crescentes e pontos de fusão decrescentes;
b) Rigorosamente segundo suas massas atômicas crescentes e, salvo algumas exceções, também segundo seus raios atômicos crescentes;
c) De maneira tal que os ocupantes de uma mesma família têm o mesmo número de níveis de energia;
d) De tal modo que todos os elementos de transição se localizam no mesmo período;
e) De maneira tal que o volume atômico, ponto de fusão e energia de ionização variam periodicamente.
16) Dados os elementos de números atômicos 3, 9, 11, 12, 20, 37, 38, 47, 55, 56 e 75, assinale a opção que só contém metais alcalinos:a) 3, 11, 37 e 55
b) 3, 9, 37 e 55
c) 9, 11, 38 e 55
d) 12, 20, 38 e 56
e) 12, 37, 47 e 75
b) 3, 9, 37 e 55
c) 9, 11, 38 e 55
d) 12, 20, 38 e 56
e) 12, 37, 47 e 75
17) Considere as afirmativas abaixo:
I - A primeira energia de ionização é a energia necessária para remover um elétron de um átomo neutro no estado gasoso.
II - A primeira energia de ionização do sódio é maior do que a do magnésio.
III - Nos períodos da tabela periódica, o raio atômico sempre cresce com o número atômico.
IV - A segunda energia de ionização de qualquer átomo é sempre maior do que a primeira.
São afirmativas CORRETAS:
a) I, II, III e IV
b) I e IV
c) I e II
d) II e III
e) II e IV
18) Qual dos elementos é metal alcalino-terroso?
a) Ca
b) P
c) N
d) Cs
e) Sn
19) Considerando um Grupo ou Família na Tabela Periódica, podemos afirmar em relação ao raio atômico:
a) Aumenta com o aumento do número atômico, devido ao aumento do número de camadas.
b) Aumenta à medida que aumenta a eletronegatividade.
c) Não sofre influência da variação do número atômico.
d) Diminui à medida que aumenta o número atômico, devido ao aumento da força de atração do núcleo.
e) Diminui com o aumento do número atômico, devido ao aumento do número de elétrons.
20) Fazendo-se a associação entre as colunas a seguir, que correspondem às famílias de elementos segundo a Tabela Periódica, a seqüência numérica será
1- Gases Nobres ( ) Grupo 1
2- Metais Alcalinos ( ) Grupo 2
3- Metais Alcalinos Terrosos ( ) Grupo 16
4- Calcogênios ( ) Grupo 17
5- Halogênios ( ) Grupo 18
a) 1, 2, 3, 4, 5
b) 2, 3, 4, 5, 1
c) 3, 2, 5, 4, 1
d) 3, 2, 4, 5, 1
e) 5, 2, 4, 3, 1
Gabarito:
1) Letra E. O raio do íon negativo F-(ânion) é maior que o raio do íon positivo Mg2+ (cátion).
2) Letra B. Em um mesmo período a energia de ionização (E.I.) aumenta da esquerda para a direita. Como a família dos Gases Nobres se localiza na extremidade mais à direita da tabela, corresponde aos elementos que apresentam maior energia de ionização.
3) Alternativa E. O Potássio (K) e o Bromo (Br) se localizam no mesmo período, só que em lados opostos: K na extremidade esquerda da tabela e Br na extremidade direita. Em um mesmo período, o raio atômico aumenta da direita para a esquerda na tabela.
a) (INCORRETA) hidrogênio não é um metal alcalino, é um gás.
b) (INCORRETA) nitrogênio é o elemento mais eletronegativo da 15ª coluna.
c) (INCORRETA) sódio é o elemento mais eletropositivo do 3° período.
d) (INCORRETA) mercúrio é um METAL líquido à temperatura ambiente.
4) Alternativa C. F- apresenta o maior raio iônico, ou energia de ionização. Quanto menor o tamanho do átomo, maior será o raio iônico.
5) E
6) B
7) A) Alternativa verdadeira. Os calcogênios possuem seis elétrons na camada de valência.
B) Alternativa falsa. Se o elemento encontra-se no quarto período, ele possui quatro camadas eletrônicas.
C) Alternativa verdadeira.
D) Alternativa falsa. Possui alta eletronegatividade, uma vez que a eletronegatividade cresce para a direita.
E) Alternativa verdadeira. O oxigênio pertence à família 6A e é também, portanto, um calcogênio.
8) A) Alternativa verdadeira. É o elemento de maior eletronegatividade da tabela.
B) Alternativa falsa. Apresenta alto potencial de ionização, visto que se encontra à direita na tabela.
C) Alternativa falsa. O ponto de fusão do flúor não é elevado: ele é um ametal.
D) Alternativa falsa. O flúor é um ametal e não pode, portanto, apresentar características metálicas.
E) Alternativa falsa. É um ametal e, como substância simples diatômica, é um composto molecular e, por isso, não conduz muito bem corrente elétrica.
9) O raio atômico cresce para a esquerda e para baixo, então, a alternativa correta é a representada pela letra "e": Li < Na < K < Rb < Cs.
10) A) Alternativa falsa. O sódio é mais denso.
B) Alternativa falsa. O sódio é menos volátil.
C) Alternativa falsa. O sódio é um metal e, portanto, apresenta maior caráter metálico.
D) Alternativa falsa. A energia de ionização cresce para a direita num mesmo período e o cloro está muito mais à direita que o sódio.
E) Alternativa verdadeira. O raio atômico cresce para a esquerda em um mesmo período e o cloro está mais à direita.
11) BB) Alternativa falsa. O sódio é menos volátil.
C) Alternativa falsa. O sódio é um metal e, portanto, apresenta maior caráter metálico.
D) Alternativa falsa. A energia de ionização cresce para a direita num mesmo período e o cloro está muito mais à direita que o sódio.
E) Alternativa verdadeira. O raio atômico cresce para a esquerda em um mesmo período e o cloro está mais à direita.
12) D
13) D
14) C
15) E
16) A
17) B
18) A
19) A
Legau
ResponderExcluirAgora você deve estudar Português !
ExcluirDIFICIL DEMAIS ESSE NEGOCIO!! CARAMBOLA!!
ResponderExcluirPau no seu Cu
ExcluirP-Au-N-O-S-Eu-Cu
ExcluirP-Au-N-O-S-Eu-Cu
ExcluirPau no seu Cu
Excluirmds, alguem me ajuda, nao consegui fazer a questão 20,18,7,8,2,16
ResponderExcluirP-Au-N-O-S-Eu-C
ResponderExcluirP-Au-N-O-S-Eu-C
ResponderExcluirmds, alguem me ajuda, nao consegui fazer a questão 20,18,7,8,2,16
ResponderExcluir