Os ácidos carboxílicos são caracterizados pelo grupo carboxila (-COOH) , ligado à um carbono da cadeia principal. A fórmula estrutural plana da carboxila é:

Esses compostos são ácidos fracos, mesmo assim são os compostos orgânicos mais ácidos. Quando têm mais de 10 carbonos, são conhecidos como ácidos graxos. No ser humano, esses ácidos estão presentes no suor, o que faz com que alguns animais reconheçam seus donos apenas pelo cheiro que exalam.
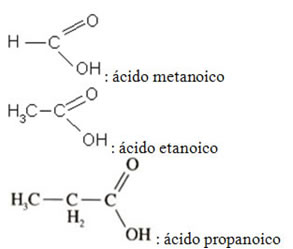
O ácido carboxílico mais simples estruturalmente é o ácido metanoico (HCOOH), mais conhecido como ácido fórmico. Este ácido é chamado “fórmico” porque vem da picada das formigas, estando presente, ainda, nas urtigas e no ferrão das abelhas. Trata-se de um líquido incolor, solúvel em água, forte e irritante. Em contato com a pele pode causar bolhas, coceiras e inchaço (quem nunca tomou uma picada de formiga ou de abelha?).
Mas quem pensa que o ácido metanoico só serve para causar dor e coceira quando vítima de uma picada está enganado. Este ácido tem diversas aplicações úteis no nosso dia-a-dia. O ácido fórmico pode ser usado no tingimento de lãs, no curtimento de peles de animais, como conservante de sucos de frutas e também na produção de desinfetantes.
Outro ácido carboxílico bastante conhecido e importante é o ácido etanoico. Usualmente chamado de ácido acético, está presente no vinagre que temperamos as saladas (5% do nosso vinagre é de ácido acético, o resto é água). Líquido incolor, de sabor azedo e solúvel em água, é usado na alimentação e na produção de alguns compostos orgânicos como plásticos, ésteres, acetatos de celulose e acetatos inorgânicos.
O ácido etanoico pode ser obtido a partir da fermentação do vinho, por meio da reação abaixo representada:
Nomenclatura dos ácidos carboxílicos
Sua nomenclatura oficial segue as seguintes regras:
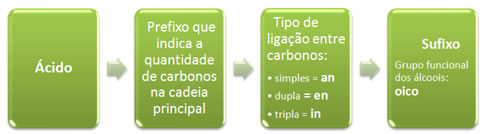
Veja alguns exemplos simples:
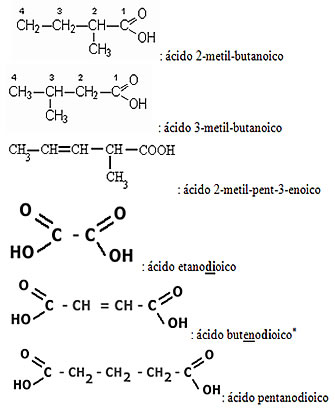
Visto que o carbono só pode fazer quatro ligações, o grupo carboxila sempre aparecerá no início ou no final da molécula. Portanto, não é necessário numerar a posição do grupo funcional. Já as insaturações e as ramificações precisam ser sempre numeradas. Lembre-se de dois pontos importantes ao numerar uma cadeia:
- A numeração sempre deve começar a partir da extremidade mais próxima do grupo funcional;
- As ramificações são colocadas em ordem alfabética.
Além disso, se houver mais de um grupo carboxila, isso é indicado pelos sufixos: di, tri, tetra, etc.
Aplicando esses pontos, temos:
Propriedades físicas dos ácidos carboxílicos
Como se poderia prever pela estrutura molecular, os ácidos carboxílicos são substâncias polares e podem, como os álcoois, formar ligações de hidrogênio entre si ou com moléculas de outra espécie. Por essa razão, os ácidos carboxílicos apresentam praticamente o mesmo comportamento dos álcoois, quanto à solubilidade. Os ácidos com até 4 carbonos são líquidos incolores, miscíveis com a água, os ácidos de 5 a 9 carbonos são líquidos incolores e viscosos, muito pouco solúveis. Os ácidos com dez ou mais carbonos são sólidos brancos, semelhante à cera, insolúveis em água. O ácido aromático mais simples, o ácido benzóico, por apresentar já elevado número de carbonos, não tem apreciável solubilidade em água. Os ácidos carboxílicos são solúveis em solventes menos polares, como o éter, o álcool, o benzeno.
O cheiro característico dos ácidos alifáticos mais baixos passa progressivamente de forte e irritante nos ácidos fórmico e acético, para extremamente desagradável (semelhante à manteiga rançosa) nos ácidos butírico (4C), valérico (5C) e capróico (6C). Os ácidos mais altos não têm muito odor, por serem pouco voláteis.
Comparando-se um ácido carboxílico e um álcool, ambos com o mesmo número de carbonos, o ácido terá maior ponto de ebulição, devido à formação de duas pontes de hidrogênio e não apenas uma, como no álcool.
Veja:
Propriedades químicas dos ácidos carboxílicos
Os ácidos carboxílicos possuem caráter ácido devido à sua ionização em água:  .
.
Essa força ácida pode ser maior ou menor dependendo do tipo de efeito indutivo causado pelo grupamento ligado à carboxila:
No primeiro caso (a) o grupo X é elétron-atraente. O efeito indutivo é -I e, portanto, deixa a carbonila com déficit eletrônico, o que leva a um enfraquecimento da ligação com o hidrogênio ácido. Logo, será mais fácil a liberação do próton. Assim, o caráter ácido aumenta.
No segundo caso (b) o grupo X é elétron-repelente. O efeito indutivo é +I e, portanto, deixa a carbonila com superávit eletrônico, o que leva a um aumento da força de ligação com o hidrogênio ácido. Logo, será mais difícil a liberação do próton. Assim, o caráter ácido diminui.
Os ácidos aromáticos comportam-se de maneira semelhante quando neles se inserem grupos substituintes. Assim, a introdução de grupos Ch2, OH ou NH2 (efeito indutivo -I) no ácido benzóico, por exemplo, conduz a ácidos mais fracos do que ele; já a introdução de grupos Cl, Br ou NO2 (efeito indutivo +I) conduz a ácidos mais fortes. Também influencia sobre a força ácida o efeito da ressonância do anel aromático, que enfraquece o ácido devido à deslocalização de cargas elétricas.
Sais de ácidos carboxílicos
Embora muito mais fracos que os ácidos inorgânicos fortes (sulfúrico, nítrico, clorídrico), os ácidos carboxílicos podem reagir completamente com hidróxidos, produzindo os respectivos sais; soluções de ácidos minerais (h2O+) realizam a transformação inversa:

Os sais dos ácidos carboxílicos, como todos os sais, são sólidos cristalinos formados por íons positivos e íons negativos. As intensas forças eletrostáticas existentes entre esses íons só são vencidas por altas temperaturas ou por ação de solventes altamente polares. Os sais carboxílicos dos metais alcalinos são solúveis em água, mas insolúveis em solventes apolares. A maioria dos outros sais são insolúveis.
Para solubilizar um ácido carboxílico insolúvel em água, podemos usar uma solução aquosa de hidróxido de sódio ou de bicarbonato, transformando o ácido em seu respectivo sal.
Veja:

Aplicações dos ácidos carboxílicos
Os ácidos carboxílicos encontram numerosas aplicações na indústria e no laboratório, mas sem dúvida os mais representativos são os ácidos fórmico e acético.
Veja os seus principais usos:
Ácido fórmico:
Tingimento e acabamento de tecidos
Produção de ácido oxálico e outros produtos orgânicos
Desinfetante em medicina e na produção de bebidas
Fabricação de polímeros
Ácido acético:
Produção de acetato de vinila (plástico PVA)
Produção de anidrido acético e cloreto de vinila, importantes em sínteses orgânicas
Fabricação de ésteres, importantes como solventes, em perfumaria e essências artificiais
Produção de acetato de celulose (fibras têxteis artificiais)
Na fabricação do vinagre
Importância dos ácidos carboxílicos
O grupo carboxila se mostra particularmente importante para a vida, animal e vegetal, possibilitando aos aminoácidos a formação de longas cadeias peptídicas, e com estas as proteínas.
Essas moléculas orgânicas são as mais abundantes nos animais e desempenham importantíssimos papéis em todos os aspectos do metabolismo celular, como: estrutural (pele, tendões, cabelo), enzimático (catálise metabólica), transporte (hemoglobina), contrátil (fibra muscular), proteção (anticorpos), hormonal (insulina) e toxinas. Observe, a seguir, as representações de alguns aminoácidos.
Exemplos de aminoácidos

Ácido glutâmico

Triptofano

Ácido aspártico

Histidina

Os aminoácidos também executam muitas funções biológicas, entre outras a de precursores de metabólitos, como a serotonina e a histamina.
Os lipídeos representam outro grupo de biomoléculas fundamentais para a vida. Em grande parte, são ácidos graxos, ou derivados destes, que respondem por numerosas e diversificadas funções do metabolismo. Mais de 500 foram isolados de células e tecidos.
Alguns ácidos graxos de ocorrência mais freqüente são listados a seguir com seus respectivos nomes, oficiais e comuns, número de carbonos e pontos de fusão.
Tabela 1 – Ácidos graxos naturais

Ácidos graxos são classificados, como saturados ou insaturados. Com duas ou mais duplas, são chamados de poliinsaturados.
Os ácidos graxos insaturados naturais têm as seguintes características:
cadeia com número par de átomos de carbononunca são ramificadosas duplas nunca são conjugadastodas as duplas ligações têm configuração Z (cis), sem exceção.
Compare na tabela anterior os pontos de ebulição dos ácidos graxos insaturados com os dos saturados de mesmo número de átomos de carbono. Observe também a variação do ponto de ebulição em função do número de duplas ligações.
Como conseqüência da configuração cis nos ácidos graxos insaturados, as cadeias dobram-se inviabilizando o seu empacotamento firme, como os das cadeias saturadas, “estiradas” e com maior superfície de contato. Com a redução dos pontos de contato intermoleculares, há grande perda sobre as forças de London e, como conseqüência, os ácidos graxos insaturados apresentam pontos de ebulição menores do que os saturados. Quanto maior o número de duplas, ainda menor o ponto de ebulição.

O ácido linoléico é o precursor de uma variedade de outros ácidos denominados de icosanóides, que nosso metabolismo produz para ações fisiológicas complexas e altamente importantes.
É um ácido graxo essencial, deve ser incluído na dieta porque os mamíferos não têm enzimas para introduzir duplas ligações na cadeia além do carbono 9. Nosso organismo converte o ácido linoléico, com 18 átomos de carbono e duas insaturações, no ácido araquidônico, com 20 átomos de carbono e quatro insaturações cis não conjugadas. E, a partir deste, nosso organismo produz as prostaglandinas (também ácidos carboxílicos), assim denominadas por haverem sido descobertas nos anos 30 a partir de secreções da próstata. As prostaglandinas podem ser consideradas como hormônios locais por exercerem funções reguladoras no mesmo tecido especializado em que são produzidas, controlando, por exemplo, a pressão sanguínea, o processo inflamatório, a atividade digestiva, a contração do útero, a secreção das paredes do estômago, a coagulação sanguínea, a febre, a dor, o fluxo sanguíneo aos órgãos em particular, o transporte de íons através das membranas; e modulando a transmissão sináptica e a indução do sono.
Confira, a seguir, as representações dos ácidos precursores e do esqueleto prostaglandina básico.

Ácido linoleíco

Ácido araquidônico

Esqueleto prostaglandina básico
A estrutura prostaglandina básica consiste em um anel de cinco membros, com dois substituintes trans e em carbonos vizinhos. Ambos substituintes são lineares, um com oito carbonos e o outro, contendo a carboxila, com sete. As prostaglandinas diferem entre si por variações estruturais no anel de cinco membros, quanto à presença de uma dupla carbonocarbono, de um grupo carbonila, de um grupo hidroxila e das posições desses membros no anel. Nas cadeias, as diferenças incluem insaturações e a presença ou não de grupo hidroxila.
Tais diferenças são expressas com letras e índices.
Veja alguns exemplos a seguir:

A partir de uma prostaglandina nascente, nosso metabolismo forma outros três ácidos carboxílicos relacionados: prostaciclinas, tromboxanos e leucotrienos, representados a seguir.

Prostaciclina PGI2

Leucotrieno B4

Tromboxano TXA2
Leucotrienos, ácidos com três duplas ligações conjugadas, primeiramente encontrados nos leucócitos (por isso, recebe esse nome), induzem contração dos músculos das vias aéreas ligadas aos pulmões e estão implicados em reações alérgicas, inflamatórias e ataques cardíacos. São compostos que ocasionam os sintomas da asma e também estão implicados em choques anafiláticos. Tromboxanos são vasoconstritores e estimulam agregação plaquetária, a primeira etapa na coagulação sanguínea. Já as prostaciclinas são vasodilatadoras e inibem a agregação plaquetária, tendo o efeito oposto.
Ainda sobre os lipídeos, deve-se destacar a importância dos ácidos biliares cólico e deoxicólico. Eles têm como precursor o colesterol, são sintetizados no fígado, armazenados na vesícula e secretados no intestino delgado, no qual atuam como agentes emulsificantes para que óleos e gorduras possam ser digeridos por enzimas hidrossolúveis. Confira as estruturas desses dois ácidos na ilustração seguinte.

Ácido cólico

Ácido deoxicólico

Ácido cítrico
O ácido cítrico, das frutas cítricas, é um metabólito central para nossas vidas. É tão importante na via metabólica, chamada de ciclo de Krebs, que este é conhecido como Ciclo do Ácido Tricarboxílico (CAT).
O ácido pirúvico é outro metabólito produzido em nosso organismo na última etapa da glicólise, uma importantíssima via para extrair energia pela oxidação da glicose sem requerer oxigênio. Organismos empregam a glicólise para prover moléculas precursoras para vias aeróbicas, tais como o ciclo do ácido tricarboxílico.

O ácido pirúvico formado, dependendo do metabolismo, tem três destinos: a redução a ácido lático (fermentação lática); a descarboxilação e redução a etanol (fermentação alcoólica); ou, sob condições aeróbicas, a descarboxilação e oxidação a Acetil-CoA, combustível para o CAT retirar energia liberando CO2 e água.
Observe as equações:

Ácidos carboxílicos têm grande valor na medicina como o analgésico ácido acetilsalicílico (AAS), conhecido como aspirina, o aminoácido L-DOPA, empregado no tratamento do mal de Parkinson, e o antiinflamatório Ibuprofeno. Observe as estruturas.

Ácido acetilsalicílico - Apirina

L-DOPA - fármaco - tratamento do mal de Parkson

Ibuprofeno - analgésico e antiinflamatório
O ácido adípico tem importância industrial histórica como matéria-prima para obtenção de derivados de ácido. Na década de 30, ele foi empregado para a produção do poliéster polietileno, pela reação com o etanodiol (veja a aula 8), e da poliamida Nylon 66, a primeira fibra puramente sintética, assim chamada por ser sintetizada de dois monômeros diferentes, cada um contendo seis átomos de carbono.

A despeito de todas essas ilustrações, os ácidos carboxílicos não são importantes apenas por si mesmos. O grupo carboxila é o original de uma família de derivados de grande importância biológica e industrial.
Cetonas
São compostos orgânicos que possuem o radical ou grupo funcional carbonila.
Apresentam-se como um líquido de odor irritante e se dissolvem tanto em água como em solventes orgânicos.
As características das cetonas permitem a sua utilização como solvente de tintas, vernizes e esmaltes. Na indústria alimentícia, desempenham um importante papel: extração de óleos e gorduras de sementes de plantas. Essas plantas são em geral a soja, girassol e amendoim.
A comercialização de cetonas é feita sob o controle do Departamento de entorpecentes da Polícia Federal, por ser usada para extrair cocaína em folhas de coca.
As características das cetonas permitem a sua utilização como solvente de tintas, vernizes e esmaltes. Na indústria alimentícia, desempenham um importante papel: extração de óleos e gorduras de sementes de plantas. Essas plantas são em geral a soja, girassol e amendoim.
A comercialização de cetonas é feita sob o controle do Departamento de entorpecentes da Polícia Federal, por ser usada para extrair cocaína em folhas de coca.
Nomenclatura das cetonas:
OFICIAL:
_______________ + indicativo de ligação + ONA
Prefixo
USUAL:
_______________ – ________________ CETONA
Radical menor Radical maior
Exemplos:
a)
OFICIAL: propanona
USUAL: dimetil cetona ou acetona (cetona comum)
USUAL: dimetil cetona ou acetona (cetona comum)
b)
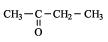
OFICIAL: butanona
USUAL: metil-etil-cetona
USUAL: metil-etil-cetona
c)
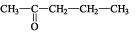
OFICIAL: 2-pentanona
USUAL: metil-propil-cetona
USUAL: metil-propil-cetona
d)
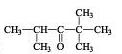

OFICIAL: 2,2,4- trimetil pentanona
USUAL: isopropil-terc-butil cetona
USUAL: isopropil-terc-butil cetona
Ésteres
Os Ésteres são compostos orgânicos que apresentam fórmula geral R − COO − R1, são caracterizados pelo grupo funcional:
O
║
− C − O −
R e R1 são radicais orgânicos, veja o exemplo:
O
║
H3C − C − O − CH3
Etanoato de metila ou
acetato de metila
Os ésteres, nas condições ambientes, se apresentam como líquidos ou sólidos, dependendo da quantidade de carbono. Os primeiros membros da série, os que apresentam baixa massa molecular, são líquidos incolores, de cheiro agradável. No entanto, à medida que se aumenta a massa molecular, vão se tornando líquidos xaroposos, viscosos e gordurosos, até se tornarem sólidos (aspecto de cera), daí ocorre a perda de cheiro agradável. São compostos insolúveis em água, porém são solúveis em álcool, éter e clorofórmio. Como não apresentam pontes de hidrogênio, os ésteres têm ponto de ebulição menor que o dos álcoois e ácidos de mesma massa molecular.
Os ésteres são utilizados na preparação de extratos artificiais que imitam o odor e o gosto de frutas, por isso são usados na fabricação de xaropes, doces, pastilhas, refrescos, etc. Os ésteres ocorrem naturalmente na natureza na forma de essências de frutas, nos óleos e gorduras (glicéridos), nas ceras e nos fosfátides (lecitina do ovo e cefalina do cérebro).
Vejamos para que são utilizadas cada uma dessas formas:
Essências: são usadas para imitar o sabor e o aroma de algumas frutas, são também chamadas de flavorizantes ou aromatizantes e muito usadas em indústria de alimentos para dar cheiro e sabor aos produtos. Exemplo: o flavorizante acetato de pentila é um ingrediente do grupo dos ésteres, e é usado para dar sabor artificial de banana em alimentos.
Óleos e gorduras: são os ésteres mais usados em nosso dia-a-dia, são encontrados em produtos como óleo de soja, margarina e azeite de oliva.
Ceras: usadas na fabricação de graxas para sapatos, cera para dar brilho a pisos, papel manteiga, velas, etc. A cera de abelha e a cera de carnaúba também fazem parte da classe de ésteres.
Alguns ésteres são usados como medicamentos, os de cadeia carbônica mais longa e que existem nos óleos e gorduras são aproveitados na produção de sabões.
O
║
− C − O −
R e R1 são radicais orgânicos, veja o exemplo:
O
║
H3C − C − O − CH3
Etanoato de metila ou
acetato de metila
Os ésteres, nas condições ambientes, se apresentam como líquidos ou sólidos, dependendo da quantidade de carbono. Os primeiros membros da série, os que apresentam baixa massa molecular, são líquidos incolores, de cheiro agradável. No entanto, à medida que se aumenta a massa molecular, vão se tornando líquidos xaroposos, viscosos e gordurosos, até se tornarem sólidos (aspecto de cera), daí ocorre a perda de cheiro agradável. São compostos insolúveis em água, porém são solúveis em álcool, éter e clorofórmio. Como não apresentam pontes de hidrogênio, os ésteres têm ponto de ebulição menor que o dos álcoois e ácidos de mesma massa molecular.
Os ésteres são utilizados na preparação de extratos artificiais que imitam o odor e o gosto de frutas, por isso são usados na fabricação de xaropes, doces, pastilhas, refrescos, etc. Os ésteres ocorrem naturalmente na natureza na forma de essências de frutas, nos óleos e gorduras (glicéridos), nas ceras e nos fosfátides (lecitina do ovo e cefalina do cérebro).
Vejamos para que são utilizadas cada uma dessas formas:
Essências: são usadas para imitar o sabor e o aroma de algumas frutas, são também chamadas de flavorizantes ou aromatizantes e muito usadas em indústria de alimentos para dar cheiro e sabor aos produtos. Exemplo: o flavorizante acetato de pentila é um ingrediente do grupo dos ésteres, e é usado para dar sabor artificial de banana em alimentos.
Óleos e gorduras: são os ésteres mais usados em nosso dia-a-dia, são encontrados em produtos como óleo de soja, margarina e azeite de oliva.
Ceras: usadas na fabricação de graxas para sapatos, cera para dar brilho a pisos, papel manteiga, velas, etc. A cera de abelha e a cera de carnaúba também fazem parte da classe de ésteres.
Alguns ésteres são usados como medicamentos, os de cadeia carbônica mais longa e que existem nos óleos e gorduras são aproveitados na produção de sabões.
Nomenclatura dos Ésteres
Hidrocarboneto + ato de (prefixo da ramificação) + ilaExemplos:
.jpg)
- etanoato de vinila - etanoato de etila - benzoato de etila
- acetato de vinila - acetato de etila
Repare que o hidrocarboneto correspondente nas duas primeiras estruturas é o etano, e por isso foi usado como prefixo.
Os nomes dos ésteres podem derivar do ácido de origem, como por exemplo, os ésteres acetato de vinila e acetato de etila recebem esta nomenclatura por serem compostos originários de ácidos carboxílicos.
Demonstração
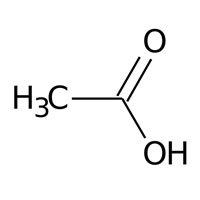
Ácido acético
Ácido acético se classifica como Ácido carboxílico, através de reações químicas dá origem ao acetato de metila, cuja fórmula linear é:
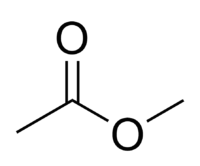
A equação é representada abaixo:
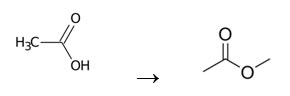
Observação: para usar esta nomenclatura é essencial saber o ácido que originou o éster
Éteres
Éteres são compostos orgânicos que apresentam o grupo funcional - O- (oxigênio) entre dois radicais (carbonos), ou seja, se caracterizam pela presença de oxigênio ligado a dois átomos de carbono.
Características físicas dos éteres: no estado líquido são muito voláteis, incolores e de cheiro agradável, não apresentam solubilidade em água, mas podem ser encontrados também na fase sólida ou gasosa. Para saber o estado físico de um éter é só observar a quantidade de carbonos: os éteres com até três carbonos se encontram no estado gasoso, os com mais de três carbonos são líquidos e os de massa molecular maior são sólidos.
Quanto às propriedades químicas, pode-se dizer que os éteres são altamente inflamáveis, apesar da pouca reatividade. A aplicação desses compostos é variada, podem ser usados para fabricar seda artificial, celulóide e ainda como solvente na obtenção de gorduras, óleos e resinas. A aplicação de éteres na medicina é importante: é usado como anestésico e para preparar medicamentos.
Uma conhecida forma de éter, muito usada em nosso cotidiano e na medicina, é o éter comum, um líquido altamente volátil que atualmente entrou em desuso em razão dos perigos de se inflamar e causar incêndios. Esse éter também é conhecido pelas denominações de éter etílico, éter dietílico ou éter sulfúrico.
Mas não é só na medicina que encontramos os éteres, são aplicados também na indústria, como solvente de tintas, óleos, resinas, graxas, em razão da propriedade que possui de dissolver esses compostos.
Nomenclatura dos éteres
Os éteres são compostos orgânicos cujo grupo funcional é caracterizado pela presença de um átomo de oxigênio (O) ligado a dois radicais orgânicos.
Segundo a IUPAC, a nomenclatura oficial para os éteres segue a seguinte regra:

Observe os exemplos abaixo:
CH3 O CH2 CH3 → met + oxi + et + an + o = metoxietano
CH3 CH2 O CH2 CH3 → et + oxi + et + an + o = etoxietano
CH3 CH2 O CH2 CH2 CH3 → et + oxi + prop + an + o = etoxipropano
CH3 O CH2 CH ═CH CH3 → met + oxi + but + en + o = metoxibuteno
CH3 CH2 O CH2 CH3 → et + oxi + et + an + o = etoxietano
CH3 CH2 O CH2 CH2 CH3 → et + oxi + prop + an + o = etoxipropano
CH3 O CH2 CH ═CH CH3 → met + oxi + but + en + o = metoxibuteno
Existe também uma segunda maneira que é aceita como nomenclatura oficial, que está descrita abaixo:
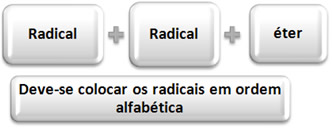
Observe agora os mesmos exemplos anteriores, porém com essa nova nomenclatura:
CH3 O CH2 CH3 → etil-metil-éter
CH3 CH2 O CH2 CH3 → dietil-éter
CH3 CH2 O CH2 CH2 CH3 → etil-propil-éter
CH3 O CH2 CH ═CH CH3 → butil-metil-éter
CH3 CH2 O CH2 CH3 → dietil-éter
CH3 CH2 O CH2 CH2 CH3 → etil-propil-éter
CH3 O CH2 CH ═CH CH3 → butil-metil-éter
Os éteres de cadeia cíclica possuem uma nomenclatura particular, que é dada por:

Exemplos:
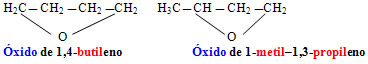
Além das nomenclaturas oficiais existe também outro sistema de nomenclatura usual denominado radicofuncional para esses compostos. Nesse sistema a regra é:
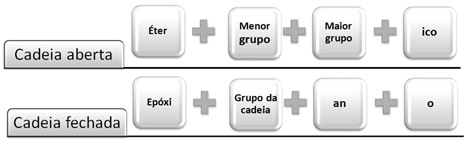
Exemplos:

Fonte: www.geocities.com
www.mundoeducaçao.com.br
www.brasilescola.com
www.alunosonline.com.br
Exercícios
1) Escreva as fórmulas estruturais e as fórmulas moleculares dos seguintes ácidos carboxílicos:
a) Ácido propenoico:
b) Ácido butanoico:
c) Ácido pentanoico:
d) Ácido hexanoico:
e) Ácido octadecanoico:
f) Ácido propanodioico:
g) Ácido butenodioico:
h) Ácido 2,2-dimetilbutanoico:
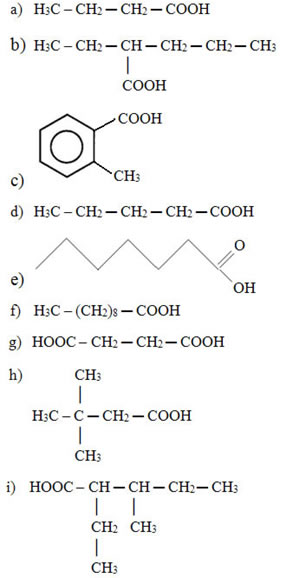
2) Forneça o nome dos seguintes ácidos, segundo as regras da IUPAC:
3) O ácido lático, obtido a partir da fermentação do leite, possui a seguinte fórmula estrutural:
A seu respeito, está correto afirmar que:
a) possui caráter básico devido à presença de duas hidroxilas;
b) na reação com hidróxido de cálcio produz o lactato de cálcio de fórmula: 

c) as ligações que ocorrem entre os átomos de carbono e de hidrogênio são de natureza iônica;
d) o número de oxidação médio do carbono é zero;
e) na sua combustão completa ocorre formação de monóxido de carbono e água.
4) (Cesgranrio – RJ)
O aroma natural de baunilha, encontrado em doces e sorvetes, deve-se ao composto de nome vanilina, cuja fórmula estrutural está reproduzida a seguir:
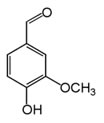
Em relação à molécula de vanilina, é correto afirmar que as funções químicas encontradas são:
a) hidrocarboneto, éter e éster
b) hidrocarboneto, ácido e fenol
c) aldeído, álcool e éter
d) aldeído, éster e fenol
e) aldeído, éter e fenol
5) O butirato de etila, largamente utilizado na indústria, é a molécula que confere sabor de abacaxi a balas, pudins, gelatinas, bolos e outros. Esse composto é classificado como
a) hidrocarboneto
b) éster
c) aldeído
d) ácido
e) ácido carboxílico
c) aldeído
d) ácido
e) ácido carboxílico
6) Os aldeídos de alto peso molecular têm odores agradáveis e são usados na fabricação de perfumes, cosméticos, sabões. O citral, por exemplo, tem forte sabor de limão e é usado como aromatizante cítrico, conheça sua fórmula estrutural:
.jpg)
a) qual o nome científico do citral?
b) qual a fórmula molecular desse composto?
c) o citral possui apenas carbonos primários?
7) Quais as características dos ácidos graxos insaturados naturais ?
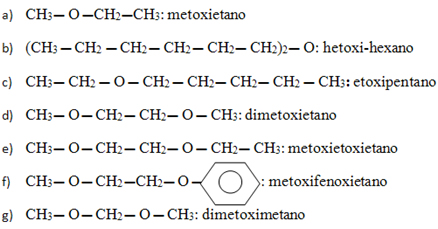
8) Forneça os nomes dos éteres que apresentam as seguintes fórmulas:
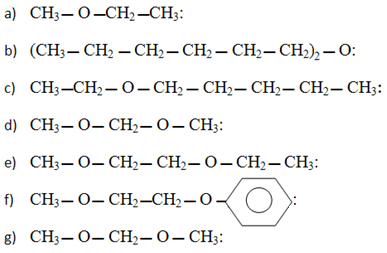
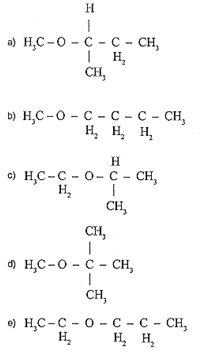
9) (Unisino-RS) Recentemente, o Conselho Nacional do Petróleo (CNP) autorizou a Petrobras a aditivar à gasolina o metil-terciobutil-éter (MTBE), tendo em vista a escassez de álcool combustível. Qual a fórmula estrutural correta do aditivo em questão?
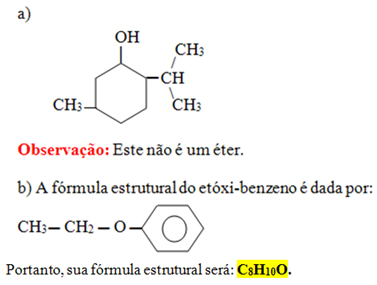
10) (UFPA) Escreva a fórmula:
a) estrutural do 2-isopropil-5-metil-ciclohexanol;
b) molecular do etóxi-benzeno
- Metoxipropano
- Metoximetano
- Propoxibutano
- Etoxibenzeno
- Etil-propil-éter
- Butil-etil-éter
- Difenil-éter
- Metoxi-sec-butano:
- Óxido de etileno
- Éter metil-terc-butil
- 1,2-epoxipropano
12) (U. Católica de Salvador – BA) A cetona é um composto carbonílico com 3 átomos de carbono e cadeia saturada. Sua fórmula molecular é:
a) C3H6O
b) C3H7O
c) C3H8O
d) C3H8O2
e) C3H8O3.
13) Dê o nome das seguintes cetonas:
a)
.exercicios.jpg)
b)
.exercicios.jpg)
c)
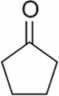
d)
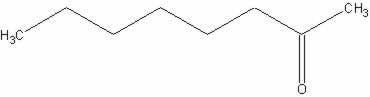
e)

Gabarito:
1)
a) Ácido propenoico: H2C ═ CH ─ COOH
b) Ácido butanoico: H3C ─ CH2 ─ CH2 ─ COOH
c) Ácido pentanoico: H3C ─ CH2 ─ CH2 ─ CH2 ─ COOH
d) Ácido hexanoico: H3C ─ CH2 ─ CH2 ─ CH2 ─ CH2 ─ COOH
e) Ácido octadecanoico: H3C ─ (CH2)16 ─ COOH
f) Ácido propanodioico: HOOC ─ CH2 ─ COOH
g) Ácido butenodioico: HOOC ─ CH ═ CH ─COOH
b) Ácido butanoico: H3C ─ CH2 ─ CH2 ─ COOH
c) Ácido pentanoico: H3C ─ CH2 ─ CH2 ─ CH2 ─ COOH
d) Ácido hexanoico: H3C ─ CH2 ─ CH2 ─ CH2 ─ CH2 ─ COOH
e) Ácido octadecanoico: H3C ─ (CH2)16 ─ COOH
f) Ácido propanodioico: HOOC ─ CH2 ─ COOH
g) Ácido butenodioico: HOOC ─ CH ═ CH ─COOH
h) Ácido 2,2-dimetilbutanoico: CH3 │
H3C ─ CH2 ─ C ─ COOH
│
CH3
H3C ─ CH2 ─ C ─ COOH
│
CH3
2) a) Ácido butanoico
b) Ácido 2-etilpentanoico
c) Ácido o-metilbenzoico
d) Ácido pentanoico
e) Ácido heptanoico
f) Ácido decanoico
g) Ácido butanodioico
h) Ácido 3,3-dimetilbutanoico
i) Ácido 2-etil-3-metilpentanoico
3) D
4) E
5) B
6) a) 3,7-dimetil-2,6-octadienal b) C10H16O c) não, o citral possui também carbonos secundários, como o localizado na extremidade inferior da molécula.
7) cadeia com número par de átomos de carbono
nunca são ramificados
as duplas nunca são conjugadas
todas as duplas ligações têm configuração Z (cis), sem exceção.
8)
9) D
10)
11)

12) A
13)
a) fenil-cetona
b) 3- pentanona
c) ciclopentanona
d) octan-2-ona
e) 3-metil-2-butanona
b) 3- pentanona
c) ciclopentanona
d) octan-2-ona
e) 3-metil-2-butanona


adorei o conteúdo
ResponderExcluir