A função sal é caracterizada por compostos iônicos que apresentam, ao menos, um cátion diferente de H+ e, no mínimo, um ânion diferente de (OH)-. Exemplos: o sal de cozinha (NaCl), o mármore (CaCO3), o gesso (CaSO4), entre outras substâncias.
Uma característica importante dos sais é que eles podem ser obtidos da reunião entre ácidos e bases.
Os sais compostos encontrados na natureza no estado sólido geralmente sob a forma de minerais, ou dissolvidos, como no caso do cloreto de sódio ou sal de cozinha (NaCl) presente na água do mar.
Muitos sais apresentam sabor salgado, alguns apresentam alta solubilidade em água, e outros apresentam valores de solubilidade tão pequenos que não considerados insolúveis, como é o caso do carbonato de cálcio (CaCO3), um constituinte do mármore.
Quando um sal se dissolve em água, ele sofre uma dissociação semelhante à que ocorre com as bases, visto que também é um composto iônico e, nessas dissociação, são liberados íons.
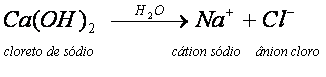
O NaCl, ao ser dissolvido em água, sofre dissociação, originando os íons livres Na+ e Cl-. Normalmente, sais que contêm um metal em sua composição, apresentam-no ligado ao restante da estrutura por ligação iônica. Nessa ligação ocorre a quebra e a conseqüente separação dos íons.
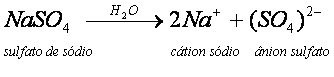
O Na2SO4, ao ser dissolvido em água, dá origem a dois íons Na+ e a um íon (SO4)2-.
Sais são compostos iônicos que possuem pelo menos um cátion diferente de H+ e, no mínimo, um ânion diferente de (OH)-.
Os sais são importantes no funcionamento do nosso organismo. Atuam, por exemplo, regulando a quantidade de água nas células e como constituintes de ossos e dentes.
Nomenclatura dos sais
Os nomes dos sais são formados pela mudança de sufixos da nomenclatura do ácido que originou o ânion participante do sal. Veja:
Os nomes dos sais são formados pela mudança de sufixos da nomenclatura do ácido que originou o ânion participante do sal. Veja:
| Sufixo do ácido | -idrico | -ico | -oso |
| Sufixo do ânion | -eto | -ato | -ito |
Para decidir os nomes dos sais, basta seguir as seguintes etapas:
Nome do sal → nome do ânion + de + nome do cátion
Veja alguns exemplos:
AgNO3
Nome do sal → nome do ânion + de + nome do cátion
Veja alguns exemplos:
AgNO3
FeSO4
Para dar nome aos ânions, você deve seguir a mesma regrinha que vimos na nomenclatura dos ácidos, na qual, a partir do nome do ânion chegávamos ao nome do ácido e vice-versa.
Vamos recordar essas regrinhas:
• Quando o ácido for um hidrácito (de terminação “–ídrico”), o ânion terá terminação “-eto”. Exemplo:
H2S = ácido sulfídrico / ânion S-2 = sulfeto.
• Quando se tratar de oxiácidos, a terminação do ânion será “-ito” para os oxiácidos terminados em “-oso” e “-ato” para os oxiácidos terminados em “-ico”. Exemplos:
H2SO3 = ácido sulfuroso / ânion SO3-2 = sulfito
H2SO4 = ácido sulfúrico / ânion SO4-2 = sulfato
Resumindo:

Mas há ânions que são provenientes de ácidos que possuem mais de um hidrogênio ionizável. Nesses ácidos poderá ocorrer uma ionização parcial, o que gerará ânions que conterão em sua fórmula o(s) hidrogênio(s) que não foi(ram) ionizados. Para esses ânions, inserimos no início de seus nomes os sufixos: mono-hidrogeno, di-hidrogeno, e assim por diante. Também podemos colocar a nomenclatura correspondente ao(s) hidrogênio(s) ionizável no fim do nome do ânion, adotando como prefixo as terminações: monoácido, diácido, etc. Exemplos:

Classificação dos sais
• Sal normal:
É um sal cujo ânion não tem nenhum hidrogênio ionizável nem grupo OH-. Sendo assim, ele só pode resultar de uma reação de neutralização total do ácido e da base envolvidos no processo. Ex.: NaCl, KBr, BaSO4.
• Hidrogenossal:
É um sal cujo ânion tem um ou mais hidrogênios ionizáveis e que não apresenta grupo OH-. Esse sal resulta de uma reação de neutralização parcial do ácido envolvido no processo. Ex.: NaHCO3, Na2HPO3, NaHSO4.
• Hidroxissal:
É um sal cujo ânion não tem hidrogênio ionizável, mas que apresenta grupo OH-. Esse sal resulta de uma reação de neutralização parcial da base envolvida no processo. Ex.: Mg(OH)Cl (hidroxicloreto de magnésio).
• Sal duplo ou misto:
É um sal que apresenta no retículo cristalino mais de um cátion ou mais de um ânion. Ex.: CaBrCl (cloretobrometo de cálcio).
• Sal hidratado:
É um tipo de sal em que se encontram, no seu retículo cristalino, moléculas de água presas aos cátions e aos ânions. Ex.: CaSO4 . 2H2O (sulfato de cálcio di-hidratado – “gesso”).
Função óxido
Os óxidos são compostos formados por apenas dois elementos químicos (compostos binários), em que obrigatoriamente um deles precisa ser o oxigênio.
Os dois exemplos mais característicos de óxidos são a água (H2O), presente em quase tudo em nosso planeta, e o gás carbônico (CO2), utilizado, por exemplo, pelos seres produtores das cadeias alimentares, no processo da fotossíntese.
Compostos binários formados por oxigênio e flúor não são considerados óxidos, pois suas propriedades se diferenciam dos óxidos em geral.
Os óxidos podem ser formados pela combinação do oxigênio com quase todos os elementos da tabela periódica, metais e ametais. São encontrados sob a forma de inúmeros minerais, destacando-se o minério de ferro (Fe2O3), chamado hematita, e o minério de alumínio (Al2O3), chamado bauxita. Esses minérios são utilizados na obtenção de ferro e de alumínio metálicos.
Óxidos são compostos binários formados por oxigênio e por outro elemento químico diferente do flúor.
Principais Óxidos e suas utilizações:
Classificação dos óxidos Os óxidos são compostos binários formados pela combinação de dois elementos, sendo um deles oxigênio. Veja como os óxidos se classificam em função do seu comportamento na presença de outros elementos: Óxidos neutros: eles não reagem com água, ácido ou base, são covalentes, ou seja, sua composição é de ametais. Exemplo: monóxido de carbono (CO). Óxidos básicos: o metal presente em sua fórmula, geralmente apresenta “carga elétrica” +1 e +2, ou seja, possuem caráter iônico. Exemplos: Na2O (Óxido de sódio), BaO (Óxido de bário). Óxidos ácidos: são formados por ametais e apresentam caráter covalente. Na presença de água produzem ácidos e na presença de bases originam sal e água. Exemplo: SO2 (óxido de enxofre). Óxidos duplos ou mistos: originados da junção de dois óxidos de um mesmo elemento. Exemplo: magnetita (Fe3O4). Aplicação: ímã natural. Óxidos anfóteros: apresentam ambiguidade, na presença de um ácido se comportam como óxidos básicos, e na presença de uma base como óxidos ácidos. Exemplo: óxido de zinco (ZnO). Peróxidos: compostos que possuem em sua fórmula o grupo (O2)2- . Exemplos: Água oxigenada (H2O2) e Peróxido de sódio (Na2O2). Aplicação: são usados na indústria como alvejantes para clarificar tecidos e polpa de celulose (confecção de papel). Superóxido: são aqueles onde o número de oxidação do oxigênio é -1/2. Um superóxido reage quimicamente produzindo um peróxido. Exemplos: superóxido de magnésio (MgO2) e superóxido de cálcio (CaO2). Nomenclatura dos óxidos A nomenclatura dos óxidos pode ser feita usando o termo óxido seguido da preposição de e do nome do elemento ligado ao oxigênio: Óxido de ........................... nome do elemento Exemplos: K2O – óxido de potássio Al2O3 – óxido de alumínio CaO – óxido de cálcio AgO – óxido de prata
Caso o elemento, metal, forme dois cátions diferentes, a distinção é feita da mesma forma que para as bases e para os sais:
FeO: óxido de ferro II ou óxido ferroso Fe2O3: óxido de ferro III ou óxido férrico Os óxidos moleculares, que são formados por ametais ligados a oxigênio, recebem uma nomenclatura especial, através do uso dos prefixos numéricos gregos: 1 = mono 2 = di 3 = tri 4 = tetra 5 = penta 6 = hexa 7 = hepta A regra é a seguinte: (mono-, di-, tri-) + óxido de + (di-, tri-, tetra-) + nome do elementoVeja alguns exemplos: PbO – monóxido de chumbo PbO2 – dióxido de chumbo Fe2O3 – trióxido de ferro FeO – monóxido de ferro N2O – monóxido de dinitrogênio N2O3 – trióxido de dinitrogênio. O uso do prefixo mono é facultativo: CO: monóxido de carbono ou óxido de carbono. Aqui vão três vídeo Exercícios 1) Assinale a alternativa que enuncia as nomenclaturas corretas dos seguintes sais, respectivamente: KCl, Na2S, AlPO4, Mg(NO2)3:
a) Cloreto de potássio, sulfeto de sódio, fosfato de alumínio, nitrito de magnésio.
b) Cloreto de potássio, sulfito de sódio, fosfito de alumínio, nitrito de magnésio.
c) Hipoclorito de monopotássio, sulfato de disódio, hipofosfito de monoalumínio, Trinitrato de monomagnésio.
d) Clorato de potássio sulfato de sódio, fosfato de alumínio, nitrato de magnésio.
2) (Puccamp-SP) O líquido de Dakin, utilizado como antisséptico, é uma solução diluída de NaClO, ou seja:
a) Perclorato de sódio
b) Hipoclorito de sódio
c) Cloreto de sódio
d) Clorato de sódio
e) Clorito de sódio.
3) (Fuvest – Sp) Molibdato de amônio é usado como fonte de molibdênio para o crescimento das plantas. Sabendo que este elemento, de símbolo Mo, pertence à mesma família do crômio, Cr, e que a fórmula do íon cromato é (CrO4)2-, a fórmula do molibdato de amônio é:
a) NH2MoO2
b) NH3MoO2
c) (NH3)2MoO4
d) NH4MoO4
e) (NH4)2MoO4
a) Perclorato de sódio. b) Hipoclorito de sódio. c) Cloreto de sódio. d) Clorato de sódio. e) Clorito de sódio. 5) No processo de produção de sal refinado, a lavagem do sal marinho provoca a perda do iodo natural, sendo necessário, depois, acrescenta-lo na forma de iodeto de potássio. Outra perda significativa é a de íons magnésio, presentes no sal marinho na forma de cloreto de magnésio e sulfato de magnésio. Durante este processo são também adicionados alvejantes, como o carbonato de sódio. As fórmulas representativas das substâncias destacadas no texto anterior são, respectivamente: a) KI, MgCl, MgSO4 e NaCO3. b) K2I, MgCl2, Mg2SO4 e Na2CO3. c) K2I, Mg2Cl, MgSO4 e Na(CO3)2. d) KI, MgCl2, MgSO4 e Na2CO3. e) KI2, Mg2Cl, Mg(SO4)2 e Na3CO3. 6) Associe corretamente, de cima para baixo, os itens a seguir: Na2B4O7. 10 H2O (IV)I- sal básico. Mg(OH)Cl (I)II- sal duplo.NaKSO4 (II)III - sal ácido.NaHCO3 (III)IV - sal hidratado. A associação correta é: a) I, III, IV, II. b) II, IV, III, I. c) I, II, III, IV. d) II, III, IV, I. e) IV, I, II, III. 7) Relacione as colunas, apresentando o sal que está presente em cada um dos produtos utilizados no cotidiano. a) Cloreto de sódio – NaCl ( ) Mármore b) Carbonato de cálcio – Na2CO3 ( ) Água sanitária c) Hipoclorito de Sódio – NaOCl ( ) Sal de cozinha d) Carbonato de cálcio – CaCO3 ( ) Soda 8) (Unifor-CE) Os íons Ca2+, ClO- e Cl- compõem o sal de fórmula:
a) Ca(ClO)Cl
b) Ca(ClO)Cl2
c) Ca(ClO)2Cl
d) Ca2(ClO)2Cl
e) Ca(ClO)2Cl2
a) NaOH, Ca3(PO)2, NaCl
b) NaCl, CaSO4, FePO4
c) HCl, H2O, Ca3(PO)2
d) NaOH, HCl, H2O2
e) HCl, CaSO4, FePO4.
10) Dentre os óxidos abaixo, qual deles reage com base formando sal e água, ou seja, que pode ser classificado como óxido ácido? a) MgO b) K2O c) Na2O d) SO2
e) H2O2
11) Dentre os óxidos abaixo, qual deles reage com ácido formando sal e água, ou seja, que pode ser classificado como óxido básico? a) N2O b) CaO c) CO2 d) SO2
e) N2O5
12) (Mackenzie/SP)
N2O5 + H2O → 2 HNO3
CO + H2O → não reage K2O + H2O→2 KOH Nas equações acima, do comportamento mostrado pelos óxidos conclui-se que: a)K2O é um peróxido b) CO é um óxido neutro ou indiferente c) K2O é um óxido ácido d) N2O5 é um óxido duplo ou misto e) N2O5 é um óxido básico 13) Faça a associação correta entre as colunas abaixo:
14) (UTFPR) "Dentre as várias alternativas existentes para a produção de radicais hidroxilas pode ser dado destaque à fotocatálise heterogênea, principalmente na presença de TiO2, fotocatálise assistida por H2O2 e sistemas Fenton que se utilizam de FeSO4, processos esses muito explorados para degradação de inúmeros poluentes orgânicos de relevância ambiental". As substâncias em destaque são:
a) óxido de titânio (um óxido), água oxigenada, sulfato férrico (uma base). b) dióxido de titânio (um óxido), água destilada, sulfato férrico (um ácido). c) dióxido de titânio (uma bas e), água destilada, sulfato férrico (um sal). d) dióxido de titânio (um óxido), água oxigenada, sulfato ferroso (um sal).
e) dióxido de titânio (um óxido), água destilada, sulfato ferroso (um tetróxido).
a) MgO b) KO c) MnO d) CaO e) Ag2BaCO3 16) Forneça a nomenclatura para cada óxido molecular:
a) NO
b) CO2
c) Fe2O3
d) PbO
e) N2O3
f) SO2
17) Alguns óxidos recebem nomes especiais e assim ficam popularmente conhecidos. Forneça a nomenclatura convencional (estabelecida por regras) e usual (popular) para os seguintes óxidos iônicos:
a) Fe2O3
b) CuO
c) FeO
d) Cu2O
18) Óxidos iônicos são aqueles formados por metais, veja a seguir uma lista desses compostos. Relacione os óxidos a suas respectivas fórmulas:
(1) Óxido de lítio ( ) K2O
(2) Óxido de sódio ( ) CaO (3) Óxido de prata ( ) Li2O (4) Óxido de cálcio ( ) AgO (5) Óxido de potássio ( ) Al2O3 (6) Óxido de alumínio ( ) Na2O
19) Os óxidos moleculares são aqueles formados por ametais ligados a oxigênio. Dê a nomenclatura dos seguintes óxidos moleculares:
a) SO
b) Cl2O7
c) CO
d) P2O5
e) N2O
f) PbO2
g) FeO
20) O elemento X forma com o oxigênio um óxido básico de fórmula XO, enquanto o elemento J forma com o oxigênio um óxido ácido de fórmula J2O. O composto formado pelos elementos X e J é:
a) metálico e apresenta fórmula mínima XJ.
b) molecular e apresenta fórmula molecular X2J3.
c) molecular e apresenta fórmula molecular XJ2.
d) iônico e apresenta fórmula mínima X2J.
e) iônico e apresenta fórmula mínima XJ2.
21) O óxido de magnésio (MgO) precisa ser substituído por um óxido que apresenta propriedades químicas semelhantes e mesma proporção de átomos. Entre os óxidos a seguir, qual você escolheria?
a) FeO b) Cão c) Na2O d) CO 22) Em qual das alternativas todos os óxidos indicados tem caráter neutro? a) CO, CO2, NO, N2O5 b) No, N2O, SO3 c) CO, NO, N2O d) CO, NO, SO3
Gabarito:
1) A alternativa correta é a letra “a”, pois a determinação da nomenclatura dos sais segue o seguinte esquema: Nome do ânion + de + nome do cátion.
Sendo que os nomes dos ânions são formados pela mudança de sufixos ídrico, ico e oso, que provêm do ácido que originou o ânion participante do sal, para os sufixos eto, ato e ito, respectivamente. Assim, temos para cada caso:
Sufixo “ídrico” passa a ser “eto”: cloreto. Por isso, o nome desse sal é cloreto de potássio.
Sufixo “ídrico” passa a ser “eto”: sulfeto. Por isso, o nome desse sal é sulfeto de sódio.
Sufixo “ico” passa a ser “ato”: fosfato. Por isso, o nome desse sal é fosfato de alumínio.
Sufixo “oso” passa a ser “ito”: nitrito. Por isso, o nome desse sal é nitrito de magnésio.
2) B
3) A alternativa correta é a letra “e”, pois se o íon molibdato é semelhante ao íon cromato CrO42-, então sua fórmula deve ser MoO42-. Visto que é um ânion bivalente e o amônio é um cátion monovalente, NH41+, então a fórmula do composto é: (NH4)2MoO4. Veja abaixo: 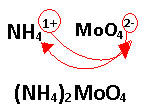 14) D 15) D 16) a) Monóxido de nitrogênio b) Dióxido de carbono c) Trióxido de diferro d) Monóxido de chumbo e) Trióxido de dinitrogênio f) Dióxido de enxofre 17) a) nomenclatura convencional: óxido de ferro III, usual: óxido férrico
b) óxido de cobre II, usual: óxido cúprico
c) óxido de ferro II, usual: óxido ferroso
d) óxido de cobre I, usual: óxido cuproso
18) (5) K2O
(4) CaO(1) Li2O (3) AgO (6) Al2O3 (2) Na2O
19) a) Trióxido de enxofre
b) Heptóxido de Dicloro
c) Monóxido de Carbono
d) Pentóxido de difósforo
e) Monóxido de dinitrogênio
f) Dióxido de chumbo
g) Monóxido de ferro
20) E
21) B
22) C
|
Isso! Muito bom, respondi a maioria e acertei-as. Isso irá me ajudar bastante na prova de amanhã!
ResponderExcluirCintia Lindaa <3
muito obrigada pelo conteúdo, me ajudou muito.
ResponderExcluir