Artigo sobre as funções nitrogenadas: aminas, amidas, nitrilas e nitrocompostos com exercícios.
Funções Nitrogenadas
Funções Nitrogenadas
Aminas
Classificação das aminas
Conforme se substituam um, dois ou três hidrogênios, as aminas podem ser primárias, secundárias ou terciárias.
Propriedades das aminas
As aminas primárias e secundárias têm uma temperatura de ebulição e de fusão mais alta que a dos hidrocarbonetos com mesmo número de carbonos, e mais baixa que a dos álcoois. Já as aminas terciárias possuem temperaturas de fusão e de ebulição inferiores às dos hidrocarbonetos de massa molecular parecida. A propriedade química mais destacada e geral das aminas é a basicidade que apresentam em dissolução aquosa.
Obtenção
As aminas são obtidas de diferentes formas. Pelo método de Hofmann, se consegue uma mistura de aminas de todos os tipos. Para tanto, se aquece, em um tubo fechado, um haleto orgânico com amoníaco. Por exemplo: CH3Cl + NH3 → HCl + CH3NH2. A metilamina pode reagir também com cloreto de metila, obtendo-se CH3 – NH2 + CH3Cl → HCl + CH3 – NH – CH3 . Já a dimetilamina (ou a amina secundária correspondente) pode reagir com outro haleto derivado, dando: CH3 – NH – CH3 + CH3Cl → HCl + N (CH3)3, (fórmula da trimetilamina).
Aplicações das aminas
No preparo de vários produtos sintéticos. Como aceleradores no processo de vulcanização da borracha.
A etanolamina (HO-CH2-CH2-NH2) é usada como tensoativo, isto é, para mudar a tensão superficial de soluções aquosas
Aminas aromáticas são muito usadas na produção de corantes orgânicos (ex: anilina)
Síntese da acetanilida e outros medicamentos.
Importância biológica das aminas
Encontram-se aminas secundárias em alguns alimentos (carne e peixe) ou no fumo do tabaco. Estas podem reagir com os nitritos (presentes nos conservantes utilizados nos produtos alimentares e usados como fertilizante, no caso das plantas, como o tabaco), levando à formação de N-nitrosaminas secundárias, que são cancerígenas.
Amidas
As amidas derivam dos ácidos orgânicos por substituição do grupo –OH da carboxila por –NH2. Sua fórmula geral é R – CONH2.
Ao contrario das aminas, não são comuns amidas com dois ou três radicais no mesmo nitrogênio. No entanto, são comuns amidas com radical alquila ou arila no nitrogênio estes são compostos “mistos”, em parte amida e em parte amina; a letra N (maiúscula) que aparece no nome indica nitrogênio
São comuns também amidas secundarias cíclicas, denominadas imidas.
Os nomes das amidas derivam dos ácidos correspondentes, trocando-se a terminação ÓICO ou ICO por AMIDA.
A formamida (H – CONH2) é um liquido incolor; as demais são sólidas. As amidas mais simples são solúveis em água devido à polaridade de suas moléculas. Seus pontos de ebulição são altos devido as formação de “pontes de hidrogenios duplas”, como acontece com os ácidos. As amidas são usadas em inúmeras sínteses; a poliamida mais importante é o náilon.
Nomenclatura das amidas
 |
As amidas são nomeadas substituindo-se a terminação ico ou óico do ácido do qual procedem pelo sufixo amida: etanamida ou acetamida (CH3 – CONH2); butanamida (CH3 – CH2– CH2 – CONH2).
Propriedades das amidas
As amidas têm pontos de fusão e de ebulição muito superiores aos dos hidrocarbonetos de mesmo peso molecular. A acetamida (CH3 – CONH2), com peso molecular 59, por exemplo, é sólida à temperatura ambiente, possui uma temperatura de fusão de 82°C e ferve a 221°C. São solúveis em solventes orgânicos comuns, como gasolina, éter ou clorofórmio. As amidas de baixo peso molecular são miscíveis com água em todas as proporções.
Obtenção
As amidas podem ser obtidas por reação entre o amoníaco e derivados dos ácidos, como os anidridos ou os ésteres. Por exemplo, com o cloreto de etila:
Nitrilas ou cianetos
As nitrilas ou cianetos possuem o grupo funcional –CN. Podem ser obtidas a partir de um derivado halogenado e cianeto de sódio ou de potássio:
Nomenclatura das Nitrilas
A nomenclatura desses compostos pode se dar de duas formas. Na primeira forma coloca-se no fim do nome a palavra “nitrila”, sendo que o restante da nomenclatura (o prefixo e o infixo) segue as mesmas regras dos outros grupos funcionais orgânicos.

Exemplos:
H ─ C ≡ N: metanonitrila
CH3 ─ C ≡ N: etanonitrila
CH2 ═ CH ─ C ≡ N: propenonitrila
CH3 ─ CH ─ C ≡ N: propanonitrila
A segunda forma é com o uso da palavra “cianeto”, que corresponde ao grupo funcional.

Exemplos:
H ─ C ≡ N: cianeto de hidrogênio
CH3 ─ C ≡ N: cianeto de metila
CH2 ═ CH ─ C ≡ N: cianeto de vinila
Usos, aplicações e obtenção das nitrilas
As nitrilas aparecem em várias partes da natureza, veja algumas dessas aparições:
* Extração de pesticidas: a etanonitrila, mais conhecida como acetonitrila, é um solvente muito utilizado em Química Orgânica para extrair pesticidas em amostras de plantas, sementes e derivados de soja. Com isso é possível identificar quais foram os pesticidas utilizados;
* Sistema de defesa de animais: o polidésmido é um animal decompositor cego, que vive nos restos de vegetais, frutas e carne. Ele se protege produzindo o ácido cianídrico, que afasta seus inimigos. O ácido cianídrico é o gás cianídrico em meio aquoso, liberando os íons H+ e CN-. Esse último íon é extremamente tóxico, podendo matar;
* Em sementes e vegetais: sementes de frutas como pêssego, uva, cereja e maçã, contêm em pequenas quantidades uma nitrila chamada amigdalina, cuja estrutura é mostrada abaixo. Além disso, esse composto também está presente nas folhas e raízes da mandioca-brava. Por isso, ao alimentar o gado com esse vegetal é necessário picá-lo bem e deixá-lo secando ao sol, para que o HCN evapore. E ao fazer alimentos para o ser humano é necessário cozinhar por bastante tempo;

* Manufatura de tecidos sintéticos: a acetonitrila ou cianeto de vinila é a nitrila mais usada para esse tipo de produção;
* Metalurgia e eletrodeposição metálica (galvanoplastia): soluções de cianeto são largamente utilizadas em indústrias para esses fins;
* Venenos: muitos filmes de espionagem ou policiais mostram que cápsulas contendo cianeto de sódio ou de potássio reagem com o ácido clorídrico do estômago e provocam a morte da pessoa por envenenamento. Um caso real disso foi o do monge russo Rasputin, que, em 1916, sofreu uma tentativa de envenenamento por cianeto que estava misturado em um pudim. Ele não morreu porque a glicose e a sacarose se combinam com o cianeto, gerando cianidrina, que não tem praticamente nenhuma toxidade.
Nitrocompostos
| Os nitrocompostos são um grupo funcional orgânico caracterizado pela ligação do grupo nitro (NO2) a uma cadeia carbônica. |
Portanto, seu grupo funcional é:
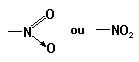
Alguns compostos orgânicos que fazem parte desse grupo funcional são:
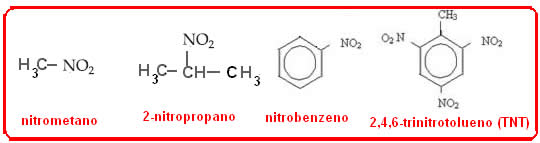
As propriedades e aplicações dos nitrocompostos alifáticos são bem diferentes em relação aos aromáticos. Os nitroalcanos são líquidos incolores, polares, insolúveis em água e usados como solventes intermediários em sínteses orgânicas. Os nitrocompostos aromáticos normalmente são usados em explosivos. O mais conhecido deles é o 2,4,6-trinitrotolueno ou TNT.
Propriedades dos nitrocompostos
Algumas propriedades dos nitrocompostos estão listadas a seguir:
.jpg)
Exercícios sobre funções nitrogenadas
1) ACK-SP) O nome da molécula
H3C – CH – CH2 – NH2 é:
│
CH3
CH3
a) metil-n-propil amina.
b) t-butil amina.
c) sec-butil amina.
d) metil-3-amino propano.
e) isobutila amina.
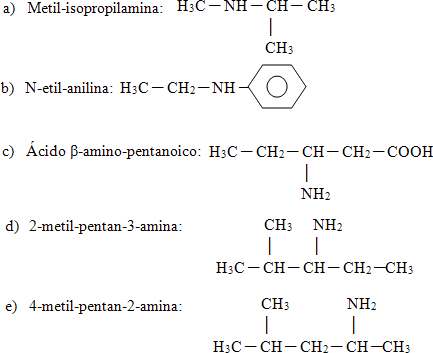
2) Escreva as fórmulas estruturais das seguintes aminas:
a) Metil-isopropilamina:
b) N-etil-anilina:
c) Ácido β-amino-pentanoico:
d) 2-metil-pentan-3-amina:
e) 4-metil-pentan-2-amina:
3) (Cesgranrio-RJ) No início de 1993, os jornais noticiaram que quando uma pessoa se apaixona, o organismo sintetiza uma substância – etilfenilamina, responsável pela excitação característica daquele estado. A classificação e o caráter químico desta amina são, respectivamente:
a) amina primária – ácido.
b) amina primária – básico.
c) amina secundária – neutro.
d) amina secundária – ácido.
e) amina secundária – básico.
4) (Cesesp-PE) Considerando as seguintes aminas:
Metilamina
Dimetilamina
Fenilamina
Escolha a alternativa que indica a ordem decrescente de basicidade:
a) II > I > III
b) III > II > I
c) I > II > III
d) III > I > II
e) II > III > I.
5) O cheiro rançoso de peixe é causado por aminas de baixa massa molar. Uma dessas aminas responsáveis pelo odor desagradável de peixe é a trimetilamina. Escreva a sua fórmula estrutural e molecular.
6) (UERJ) Um dos episódios da final da Copa da França de 1998 mais noticiados no Brasil e no mundo foi "o caso Ronaldinho". Especialistas apontaram: estresse, depressão, ansiedade e pânico podem ter provocado a má atuação do jogador brasileiro. Na confirmação da hipótese de estresse, teriam sido alteradas as quantidades de três substâncias químicas excitatórias do cérebro - a noradrenalina, a serotonina e a dopamina - cujas estruturas estão abaixo representadas:
.jpg)
a) Amida e fenol
b) Amina e fenol
c) Amida e álcool
d) Amina e álcool
7) Uma das aplicações mais importantes das aminas é na produção de medicamentos. Em remédios que combatem a gripe, por exemplo, dentre outras substâncias, pode-se encontrar a amina abaixo:
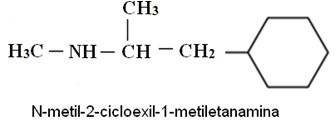
Trata-se de uma amina primária, secundária ou terciária?
8) Quando um dos hidrogênios da amônia é substituído por um radical arila, o composto resultante é:
a) amida
b) nitrila
c) amina
d) sal de amônio.
e) nitrocomposto
9) A ureia cuja fórmula estrutural aparece abaixo, está presente na urina dos mamíferos, como resultante do metabolismo dos aminoácidos. Quanto a função orgânica, essa substância pode ser classificada como:
a) Cetona b) Amida c) Amina d) Cianato.
10) O adoçante aspartame, substituto do açúcar nos alimentos dietéticos, apresenta uma molécula mais complexa que a sacarose, mostrando maior variedade de grupos funcionais. Essa variedade é comprovada pela estrutura abaixo:
Na cadeia lateral do anel aromático, além das funções ácido carboxílico e éster, também se observam
a) Amida e amina
b) Amina e cetona
c) Amina e hidrocarboneto
d) Amida e cetona.
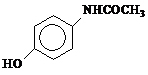
11) (UnB-DF) O acetoaminofen é uma substância que tem propriedades analgésicas e antipiréticas. Ela é comercializada com o nome de Tylenol e sua fórmula encontra-se esquematizada abaixo:
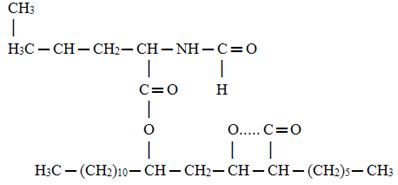
13) (UFF - 2008) A adrenalina é uma substância produzida no organismo humano capaz de afetar o batimento cardíaco, a metabolização e a respiração. Muitas substâncias preparadas em laboratório têm estruturas semelhantes à adrenalina e em muitos casos são usadas indevidamente como estimulantes para a prática de esportes e para causar um estado de euforia no usuário de drogas em festas raves. A DOPA é uma substância intermediária na biossíntese da adrenalina. Observe a estrutura da DOPA. Assinale a opção correta.

a) Identifica-se entre outras as funções fenol e amina.
b) Existem, entre outros, três átomos de carbono assimétrico (carbono quiral).
c) Verifica-se a existência de cadeia carbônica alifática insaturada.
d) Existem dois isômeros geométricos para a DOPA.
e) Verifica-se a existência de três átomos de carbono primário e de dois átomos de carbono secundário.
14) Nossos corpos podem sintetizar onze aminoácidos em quantidades suficientes para nossas necessidades. Não podemos, porém, produzir as proteínas para a vida a não ser ingerindo os outros nove, conhecidos como aminoácidos essenciais.

Assinale a alternativa que indica apenas funções orgânicas encontradas no aminoácido essencial fenilalanina, mostrada na figura acima.
a) Álcool e amida.
b) Éter e éster.
c) Ácido orgânico e amida.
d) Ácido orgânico e amina primária.
e) Amina primária e aldeído.
15) Em 1998, o lançamento de um remédio para disfunção erétil causou revolução no tratamento para impotência. O medicamento em questão era o Viagra®. O princípio ativo dessa droga é o citrato de sildenafil, cuja estrutura é representada na figura:

11) (UnB-DF) O acetoaminofen é uma substância que tem propriedades analgésicas e antipiréticas. Ela é comercializada com o nome de Tylenol e sua fórmula encontra-se esquematizada abaixo:

Assinale as alternativas corretas em relação ao acetoaminofen.
1. Pertence à classe dos fenóis;
2. Contém também a função amida;
3. Tem fórmula C8H9NO2;
4. Pertence à classe das substâncias aromáticas devido à presença do anel benzênico.
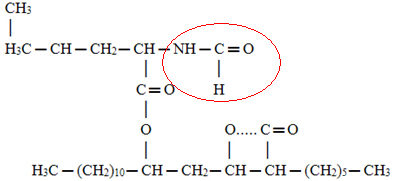
12) O princípio ativo de alguns medicamentos para obesidade é a substância cuja fórmula estrutural está representada abaixo:

Circule onde se encontra o grupo amida nessa fórmula.

a) Identifica-se entre outras as funções fenol e amina.
b) Existem, entre outros, três átomos de carbono assimétrico (carbono quiral).
c) Verifica-se a existência de cadeia carbônica alifática insaturada.
d) Existem dois isômeros geométricos para a DOPA.
e) Verifica-se a existência de três átomos de carbono primário e de dois átomos de carbono secundário.
14) Nossos corpos podem sintetizar onze aminoácidos em quantidades suficientes para nossas necessidades. Não podemos, porém, produzir as proteínas para a vida a não ser ingerindo os outros nove, conhecidos como aminoácidos essenciais.

Assinale a alternativa que indica apenas funções orgânicas encontradas no aminoácido essencial fenilalanina, mostrada na figura acima.
a) Álcool e amida.
b) Éter e éster.
c) Ácido orgânico e amida.
d) Ácido orgânico e amina primária.
e) Amina primária e aldeído.
15) Em 1998, o lançamento de um remédio para disfunção erétil causou revolução no tratamento para impotência. O medicamento em questão era o Viagra®. O princípio ativo dessa droga é o citrato de sildenafil, cuja estrutura é representada na figura:

As funções orgânicas I e II, circuladas na estrutura do citrato de sildenafil, são
a) cetona e amina.
b) cetona e amida.
c) éter e amina.
d) éter e amida.
e) éster e amida.
16) O composto CH2 ═ CH ─ C ≡ N é um(a):
a) amida
b) nitrila
c) amina
d) álcool
e) ácido carboxílico
17) Defina nitrocompostos.
18) Sobre os compostos:
I. H2C = CH - CONH2
II. CH3 - CH2 - CHO
III. H2C = CH - NH - CH2 - CH3
IV. 2ON - O - CH2 - CH3
V. CH3 - CH2 - CH2OH
São feitas as afirmações abaixo. Assinale a única falsa:
a) I é amida
b) IV é nitrocomposto
c) V é álcool
d) II é aldeído
e) III é amina.
19) “Sem a química o Natal seria muito diferente. (...) Será que Papai Noel teria presentes suficientes, em quantidade e diversidade, se a química não tivesse desenvolvido produtos como o náilon?” (Informativo CRQ – XII, dez/ 2002). O náilon é fabricado com base na reação entre um ácido dicarboxílico com uma diamina, que forma uma estrutura como a representada a seguir:

A função orgânica assinalada é chamada
a) amida
b) amina
c) éster
d) éter
e) cetona.
20) Defina nitrilas.
Gabarito:
1) E
2)
3) Estrutura da etilfenilamina:
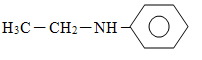
Visto que dois hidrogênios da amônia (NH3) foram substituídos, trata-se de uma amina secundária. Toda amina é básica.
Letra E.
4) As fórmulas de cada uma dessas aminas estão representadas abaixo:- Metilamina: H3C ─ NH2
- Dimetilamina: H3C ─ NH ─ CH3
- Fenilamina:
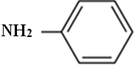
A metilamina e a dimetilamina são mais básicas que a fenilamina porque elas são alifáticas e qualquer amina alifática é mais básica do que qualquer amina aromática.
A metilamina é menos básica que a dimetilamina porque ela é primária e a dimetilamina é secundária. Aminas alifáticas secundárias são mais básicas do que aminas alifáticas primárias. Assim, a ordem decrescente de basicidade é:
Dimetilamina > metilamina > fenilamina ou II > I > III
Letra A.
5) Fórmula estrutural: H3C ─ N ─ CH3
│
CH3
Fórmula molecular: C3H9N.
6) B
7) Amina secundária.
8) C
9) B
10) A
11) Todas estão corretas.
12)
13) A
14) D
11) Todas estão corretas.
12)

13) A
14) D
15) C
16) B
17) São todos os compostos orgânicos que derivam do ácido nítrico (HNO3) através da substituição do – OH por um radical que deriva de hidrocarboneto.
18) B
19) A
20) Também conhecidas como cianetos, as nitrilas são substâncias químicas que apresentam em sua composição o grupo funcional –CN, obtidas a partir da substituição do hidrogênio do gás cianídrico ou cianeto de hidrogênio (HCN) por um radical orgânico.
16) B
17) São todos os compostos orgânicos que derivam do ácido nítrico (HNO3) através da substituição do – OH por um radical que deriva de hidrocarboneto.
18) B
19) A
20) Também conhecidas como cianetos, as nitrilas são substâncias químicas que apresentam em sua composição o grupo funcional –CN, obtidas a partir da substituição do hidrogênio do gás cianídrico ou cianeto de hidrogênio (HCN) por um radical orgânico.

Ótimo Blog.
ResponderExcluirMuito Obrigada! Ajudou muito!
ResponderExcluirObrigado. Adorei
ResponderExcluir