Energia livre de Gibbs
Energia livre de Gibbs é a energia de que o processo dispõe para realizar trabalho útil em temperatura e pressão constantes.
Visto que em um processo a energia nunca é totalmente convertida em trabalho, a fração de energia útil do sistema, isto é, que realiza o trabalho, é considerada a energia livre.
A grandeza da energia livre só é usada para calcular variações que ocorrem nos sistemas, e não para sistemas estáticos. Ela é simbolizada por ∆G. É também denominada Energia Livre de Gibbs, pois foi proposta em 1878, pelo físico americano Josiah Willard Gibbs (1839-1903), com a finalidade de avaliar a espontaneidade do sistema.
Seu cálculo é dado pela expressão matemática abaixo, que é costumeiramente chamada de equação de Gibbs-Helmholtz:

Em que:
∆G = variação da energia livre;
∆H = variação da entalpia;
T = temperatura em Kelvin (sempre positiva);
∆S = variação da entropia.
∆H = variação da entalpia;
T = temperatura em Kelvin (sempre positiva);
∆S = variação da entropia.
Para entendermos melhor como essa equação nos ajuda a determinar a espontaneidade de uma reação, relembremos brevemente cada um dos conceitos envolvidos nela:
- ∆H (variação da entalpia): Entalpia (H) é o conteúdo de energia de uma substância. Até o momento, não é conhecida nenhuma maneira de determiná-la. Na prática, o que se consegue é medir a variação da entalpia (∆H) de um processo, utilizando-se calorímetros. Essa variação é a quantidade de energia que foi liberada ou absorvida no processo.
- ∆S (variação da entropia): A entropia (S) é a grandeza termodinâmica que mede o grau de desordem de um sistema.
Por exemplo, na fusão do gelo, as moléculas passam do estado sólido para o líquido, onde há uma maior desorganização. Isso significa que nesse processo a entropia aumentou (∆S > 0).
Na produção da amônia (NH3), 1 mol de gás nitrogênio reage com 3 mol de gás hidrogênio (ou seja, 4 mol de moléculas nos reagentes), originando 2 mol de amônia:
N2(g) +3 H2(g) → 2 NH3(g)
Visto que o número de moléculas na fase gasosa diminui nesse processo, a desorganização diminuiu, o que significa que a entropia também diminuiu (∆S< 0).
- ∆G (Energia livre): A energia livre ou energia livre de Gibbs (porque foi proposta apenas por esse cientista em 1878) é a energia útil do sistema que é usada para realizar trabalho.
Um sistema possui uma energia global, mas apenas uma fração dessa energia será usada para realizar trabalho, essa é a chamada energia livre de Gibbs, simbolizada por G.
Segundo Gibbs, um processo é considerado espontâneo se realizar trabalho, ou seja, se G diminuir.Nesse caso, o estado final da transformação será mais estável que o inicial quando ∆G < 0.
Baseado nisso, podemos concluir o seguinte:
| ΔG= 0 | Sistema atingiu equilíbrio dinâmico |
| ΔG= positiva | A reação ocorre em favor dos reagentes |
| ΔG= negativa | Segue para o estado de equilíbrio |
Ou expressando por meio das equações:
Onde : R é a constante de Boltzman ou seja R= 0,082 L atm-1
T é temperatura em Kelvins(K) onde K= T em °C + 273,15
Eletroquímica e ΔG°
Quando ΔG° se aproxima de zero em uma célula eletroquímica, esta atingiu o equilíbrio. Onde, os reagentes e os produtos encontram-se na mesma quantidade e a bateria descarregou sua carga dizemos que este sistema encontra-se em equilíbrio. Diante disso um cientista chamado Nernest deduziu uma equação capaz de fornecer a força eletromotriz (fem) através da energia livre, “por que a energia livre é proporcional a fem que depende da concentração dos reagentes na célula.” Essa relação é mais bem expressa através das equações:
ΔG= ΔG° + RTlnK onde:
ΔG= -nFE e ΔG°=-nFEº substituindo,
-nfE=-nFEº+RT lnK dividindo os termos por –nF temos:
E=Eº- RT/nF lnK ( Equação de Nernest)
Questões sobre Energia livre de Gibbs
1) (UEPA) Uma reação química apresentou, a 27°C, uma variação de entalpia igual a -224,52 kcal e uma variação de entropia igual a 1,5cal/ K.mol. A variação da energia livre de Gibbs para essa reação é:
a)-674,52 cal/mol b)-674,52 kcal/mol c) -224,97 kcal/mol d) -224,97 cal/mol e) 674,52 kcal/mol .
Lembrem-se a fórmula para o cálculo da energia livre de Gibbs é G = H- TS , onde:
G = energia livre de Gibbs
H = variação de entalpia
T = temperatura em Kelvin
S = Variação da entropia
Obs: Não consegui colocar o símbolo delta referente à variação.
Dica: Para memorizar a fórmula se lembre da frase:"Gente, Hoje Tem Sol".
Solução: 27°C = 300k
1,5cal/ K.mol = 0,0015kcal/mol
G = H- TS
G = -224,52 - (300 . 0,0015)
G = -224,52 - 0,45
G = -224,97 kcal/mol.
Alternativa "C".
Solução:
1: Transformar a temperatura que está em Celsius para Kelvin e a variação de entropia de J∙K-1∙mol-1 para KJ∙K-1∙mol-1.
2: substituir na equação os dados:
3) Se Δ G < 0 para uma reação a todas as temperaturas, então Δ S é ________ e Δ H é
________.
a) positivo, positivo b) positivo, negativo c) zero, positivo d) negativo, positivo e) negativo, zero
Solução: Letra B
4) O ácido sulfúrico concentrado diluindo-se em água pode ser perigoso.A temperatura da
solução pode aumentar rapidamente. Que são os sinais de Δ H, de Δ S, e de Δ G para este
processo?
a) Δ H < 0, Δ S < 0, Δ G < 0 b) Δ H < 0, Δ S > 0, Δ G < 0 c) Δ H < 0, Δ S > 0, Δ G < 0
d) Δ H > 0, Δ S > 0, Δ G < 0 e) Δ H > 0, Δ S < 0, Δ G > 0
Solução: Letra B
5) Todas as seguintes substâncias têm uma energia livre igual a zero EXCETO:
a) He(g). b) O(g). c) S8 (s). d) Cu(s). e) Cl2 (g).
Solução: Letra B
6) Considere a vaporização de um líquido a temperatura igual a seu ponto
normal de ebulição, por exemplo, vaporização da água a 373.15 K e
pressão de 1 atm
H2O(l) → H2O(g)
• calcule a energia de Gibbs molar de vaporização
Solução:
• a uma dada temperatura, teremos
∆vap,mG =Gm[H2O(g)] − Gm[H2O(l)]
=∆vap,mH − T ∆vap,mS
=40, 65 kJ · mol−1 − T × (108, 9 kJ · K
−1
· mol−1
)
• para T = 373.15 K,
∆vap,mG = 40, 65 kJ · mol−1 − 373.15 K × (108, 9 kJ · K
−1
· mol−1
) = 0
7) Um mol de gás ideal a 298K expande isotermicamente contra o vácuo de um volume de 2 litros para um de 8 litros. Calcule q, w, ΔU, ΔA, ΔG, ΔH, ΔSsist, ΔSviz e ΔSuniv para o processo. Como se pode avaliar se o processo é espontâneo?
Solução:
- ΔG = - 110,6 kJ; a reação é espontânea sob o ponto de vista de ΔG.
- a) P; b) P; c) N; d) N; e) P; f) P
- Letra a! Basta fazer o cálculo para verificar que a reação será espontânea para qualquer temperatura, uma vez que temos variação de entalpia negativa e variação de entropia positiva.
Resposta à pergunta: Porque há também um reagente no estado gasoso. Assim, como a entropia do gás é muito maior do que a entropia do sólido, a passagem de C(s) para CO2(g) apresenta pouca influência, uma vez que já existe a passagem O2(g) para CO2(g).
- Haja vista que temos um processo de difusão de gases, o mesmo sempre será espontâneo, independente da óptica observada. Como tem-se T e P constantes, o cálculo de ΔG conduzirá, necessariamente, a um valor negativo. Letra a!
- Letra e! Como a pressão no recipiente em A é maior do que em B, o pistão se deslocará para B no intuito de ocorrer equalização da pressão. E esse processo será espontâneo e não forçado!
- ΔA = ΔG = - 58,8 kJ.
- q = 0, w = 0, ΔU = 0, ΔA = - 3434,6 J/mol, ΔG = 3434,6 J/mol, ΔH = 0, ΔSsist = + 11,52 J/(K mol), ΔSviz = 0 e ΔSuniv = + 11,52 J/(K mol).
Nesse caso, avalia-se a espontaneidade do processo através do cálculo de entropia do universo que, necessariamente, deverá levar a um valor positivo, pois sabe-se que o processo de expansão contra o vácuo é espontâneo.
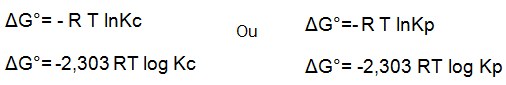
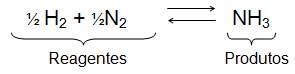
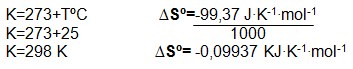
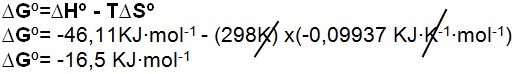
Por conta dos direitos autorias, você tem que colocar a fonte de onde pegou
ResponderExcluirSugiro republicar, porque a partir do enunciado da questão 7 há respostas para várias questões que não estão expressas no texto. Mesmo assim, estimulo o trabalho e lhes parabenizo pelo empenho.
ResponderExcluirGilson Medeiros - Professor - UFRN