Artigo sobre Eletroquímica - pilhas com um breve resumo e questões de vestibulares resolvidas.
1) (PUC) Na pilha eletroquímica sempre ocorre:
a) oxidação do catodo.
b) movimento de elétrons no interior da solução eletrolítica.
c) reação com diminuição de calor.
d) passagem de elétrons, no circuito externo, do anodo para o catodo.
e) reação de neutralização.
2)
3) (PUC-RIO 2008)
O trabalho produzido por uma pilha é proporcional à diferença de potencial (ddp) nela desenvolvida quando se une uma meia-pilha onde a reação eletrolítica de redução ocorre espontaneamente (catodo) com outra meia pilha onde a reação eletrolítica de oxidação, ocorre espontaneamente (anodo).
Com base nas semi-reações eletrolíticas acima, colocadas no sentido da oxidação, e seus respectivos potenciais, assinale a opção que indica os metais que produzirão maior valor de ddp quando combinados para formar uma pilha.
A) Cobre como catodo e prata como anodo.
B) Prata como catodo e zinco como anodo.
C) Zinco como catodo e cádmio como anodo.
D) Cádmio como catodo e cobre como anodo.
E) Ferro como catodo e zinco como anodo.
4) (UDESC 2010) Uma pilha de Daniell opera em condições padrões com soluções aquosas de ZnSO4 e CuSO4, com diferença de potencial nos terminais de ΔE0. Cristais de CuSO4 são adicionados na respectiva solução, alterando o potencial para ΔE, na mesma temperatura.
Pode-se afirmar que este novo potencial:
A) permaneceu constante.
B) aumentou.
C) diminuiu.
D) ficou zero.
E) não pode ser calculado.
5) (UDESC 2008) Os principais fenômenos estudados pela eletroquímica são a produção de corrente elétrica, através de uma reação química (pilha), e a ocorrência de uma reação
química, pela passagem de corrente elétrica (eletrólise). Com relação a esses fenômenos, analise as proposições abaixo.
I - As pilhas comuns são dispositivos que aproveitam a transferência de elétrons em uma reação de oxirredução, produzindo uma corrente elétrica, através de um condutor.
II - Em uma pilha a energia elétrica é convertida em energia química.
III - O fenômeno da eletrólise é basicamente contrário ao da pilha, pois enquanto na pilha o processo químico é espontâneo (ΔEº > 0), o da eletrólise é não-espontâneo (ΔEº < 0).
Assinale a alternativa correta.
A) Somente a proposição II é verdadeira.
B) Somente as proposições I e II são verdadeiras.
C) Somente as proposições I e III são verdadeiras.
D) Somente a proposição I é verdadeira.
E) Todas as proposições são verdadeiras.
6) (PUC-RIO 2007) Considere a célula eletroquímica abaixo e os potenciais das semi-reações:

Sobre o funcionamento da pilha, e fazendo uso dos potenciais dados, é INCORRETO afirmar que:
A) os elétrons caminham espontaneamente, pelo fio metálico, do eletrodo de níquel para o de cobre.
B) a ponte salina é fonte de íons para as meia-pilhas.
C) no anodo ocorre a semi-reação Ni(s) → Ni2+(aq) + 2e
D) no catodo ocorre a semi-reação Cu2+(aq) + 2e → Cu(s)
E) a reação espontânea que ocorre na pilha é: Cu(s) + Ni2+(aq) → Cu2+(aq) + Ni(s)7) (MACK) Em uma pilha com eletrodos de zinco e de cobre, com circuito fechado, ocorre:
a) o potencial do eletrodo de zinco diminui e o do cobre aumenta;
b) o potencial do dois eletrodos diminui;
c) o potencial do eletrodo de zinco aumenta e o do cobre diminui;
d) o potencial dos dois eletrodos aumenta;
e) o potencial dos dois eletrodos não se altera.
8) (FUVEST) Considere os potenciais padrões de redução:
semi-reação (em solução aquosa) potencial (volt)
Ce4+ + 1e- ® Ce3+ +1,61
Sn4+ + 2e- ® Sn2+ +0,15
Qual das reações deve ocorrer espontaneamente?
a) Ce4+ + Sn4+ ® Ce3+ + Sn2+
b) 2Ce4+ + Sn2+ ® 2Ce3+ + Sn4+
c) Sn4+ + Ce3+ ® Ce4+ + Sn2+
d) Ce3+ + Sn2+ ® Ce4+ + Sn4+
semi-reação (em solução aquosa) potencial (volt)
Ce4+ + 1e- ® Ce3+ +1,61
Sn4+ + 2e- ® Sn2+ +0,15
Qual das reações deve ocorrer espontaneamente?
a) Ce4+ + Sn4+ ® Ce3+ + Sn2+
b) 2Ce4+ + Sn2+ ® 2Ce3+ + Sn4+
c) Sn4+ + Ce3+ ® Ce4+ + Sn2+
d) Ce3+ + Sn2+ ® Ce4+ + Sn4+
9) (MACK) A reação que ocorre em uma pilha é representada pela seguinte equação: Mn + Cu++ ® Mn++ + Cu Sabendo-se que o potencial de óxido-redução do manganês é igual a +1,05 volts e o do cobre é igual a –0,35 volts, e admitindo-se que a concentração dos íons é unitária, a voltagem da pilha será:
a) 0,70 volts
b) –1,40 volts
c) 1,40 volts
d) –0,70 volts
e) n.d.a.
a) 0,70 volts
b) –1,40 volts
c) 1,40 volts
d) –0,70 volts
e) n.d.a.
10) (SANTA CASA) Dentre as espécies químicas representadas abaixo através de semi-reações:
15) (ITA) Uma fonte, que fornece uma corrente elétrica constante de 3,00 A, permaneceu ligada a uma célula eletrolítica contendo solução aquosa de H2SO4 e dois eletrodos inertes. Durante certo intervalo de tempo formaram-se 0,200mols de H2 em um dos eletrodos e 0,100mols de O2 no outro. Para obter as quantidades de produtos indicadas, o intervalo de tempo, em segundos, necessário será:
a) (0,200-0,100)×9,65×10-4/3,00
b) 0,200×9,65×10-4/3,00
c) (0,400-0,200)×9,65×10-4/3,00
d) (0,400+0,200)×9,65×10-4/3,00
e) 0,400×9,65×10-4/3,00
16) (UNITAU) Assinale a alternativa incorreta:
a) Eletrólise ígnea é a reação química provocada pela passagem de corrente elétrica através de um composto iônico fundido.
b) Eletrólise aquosa é a reação química provocada pela passagem de corrente elétrica por meio de uma solução aquosa de um eletrólito.
c) Com a eletrólise podemos produzir substâncias na indústria química como a soda cáustica e hipocloritos.
d) A ddp negativa indica que a reação é espontânea e que poderá ser usada para gerar corrente elétrica.
e) Na eletrólise de uma solução aquosa de KI, o íon iodeto, quando volta a ser átomo, perde um elétron.
17) (FUVEST) A eletrólise de cloreto de sódio fundido produz sódio metálico e gás cloro. Nesse processo, cada íon
a) sódio recebe dois elétrons.
b) cloreto recebe um elétron.
c) sódio recebe um elétron.
d) cloreto perde dois elétrons.
e) sódio perde um elétron.
18) (UNESP) O funcionamento de uma pilha de combustível é baseado nas semi-reações a seguir, cada uma delas representada com o respectivo potencial padrão de redução, E¡:2H2O(g) + 2e → H2(g) + 2OH(aq) E¡=-0,828 V_ O2(g)(g) + H2O(g) + 2e → 2OH(aq) E¡=0,401VLevando-se em conta estas informações, afirma-se:I) A reação global da pilha de combustível é H2(g) + _ O2(g)(g) → H2O(g) II) O hidrogênio sofre oxidação no processo. III) A diferença de potencial desta pilha de combustível, em condição padrão, é igual a 1,229V.Estão corretas as afirmações:
a) I, apenas.
b) II, apenas.
c) I e II, apenas.
d) II e III, apenas.
e) I, II e III.
19) (FUVEST) Para recuperar prata de soluções aquosas contendo íons Ag+, costuma-se adicionar zinco metálico às soluções, pois a transformação 2Ag+ + Zn¡ → 2Ag¡ + ZN2++é espontânea. Pode-se concluir então que:
a) o potencial de redução do Ag+/Ag¡ é maior do que o do ZN2++/Zn¡.
b) ocorre transferência de elétrons do Ag+ para Zn¡.
c) O Zn¡ atua como oxidante e o Ag+ como redutor.
d) o Zn¡ é menos redutor do que Ag¡.
e) ocorre a eletrólise do Ag+ e do Zn¡.
20) (FUVEST) Para pratear eletroliticamente um objeto de cobre e controlar a massa de prata depositada no objeto, foi montada a aparelhagem esquematizada na figura a seguir onde I, II e III são, respectivamente:
a) o objeto de cobre, uma chapa de platina e um amperímetro.
b) uma chapa de prata, o objeto de cobre e um voltímetro.
c) o objeto de cobre, uma chapa de prata e um voltímetro.
d) o objeto de cobre, uma chapa de prata e um amperímetro.
e) uma chapa de prata, o objeto de cobre e um amperímetro.

b) Zn.
c) Ag.
d) Sn.
e) Pb.
24) (UEL) Em qual das seguintes reações NÃO há produção de hidrogênio, H2?
a) Oxidação do iodeto de hidrogênio pelo cloro.
b) Eletrólise da solução aquosa de ácido sulfúrico.
c) Oxidação do zinco pelo ácido clorídrico.
d) Eletrólise da água acidulada.
e) Hidrólise do hidreto de sódio.
a) A reação de redução que ocorre na pilha é Cu2 + 2e → Cu (s);
b) O eletrodo de cobre é o anodo;
c) A semi-reação que ocorre no catodo é Fe¤+→ Fe2+ + e;
d) A reação total da pilha é 2 Fe¤+ + Cu (s) → 2 Fe2+ + Cu2;
| Semi-reações | Potencial padrão de Redução (volt) |
| Na+ + e- ® Na | - 2,7 |
| Cu + + e- ® Cu | +0,5 |
| ½ Cl2 + e- ® Cl- | +1,4 |
Qual, nas condições padrão, é a mais oxidante?
a) Na
b) Cu
c) Na+
d) Cu+
e) Cl2
a) Na
b) Cu
c) Na+
d) Cu+
e) Cl2
11) Numa pilha eletroquímica sempre ocorre:
a) Redução no ânodo.
b) Movimentação de elétrons no interior da solução eletrolítica.
c) Passagem de elétrons, no circuito externo, do cátodo para o ânodo.
d) Reação de neutralização.
e) Uma reação de oxirredução.
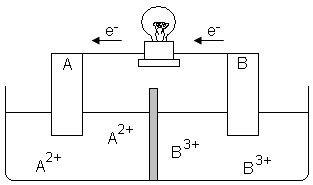
12) As pilhas e as baterias são dispositivos nos quais uma reação espontânea de oxidorredução transforma energia química em energia elétrica. Portanto, sempre há uma substância que se reduz, ganhando elétrons, que é o cátodo, e uma que se oxida, perdendo elétrons, que é o ânodo. Abaixo, temos um exemplo de uma pilha eletroquímica:

A respeito dessa pilha, responda:
a) Qual eletrodo, A ou B, está sofrendo redução e qual está sofrendo oxidação?
b) Qual eletrodo é o cátodo e qual é o ânodo?
c) Escreva a semirreação que ocorre nos eletrodos A e B e a reação global da pilha.
d) A concentração dos íons B3+ e A2+ aumenta ou diminui?
e) Ocorre corrosão ou deposição dos eletrodos A e B?
13) (Vunesp) A equação seguinte indica as reações que ocorrem em uma pilha:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Podemos afirmar que:
a) O zinco metálico é o cátodo.
b) O íon cobre sofre oxidação.
c) O zinco metálico sofre aumento de massa.
d) O cobre é o agente redutor.
e) Os elétrons passam dos átomos de zinco metálico aos íons de cobre.
14) (FUVEST) Água contendo Na2SO4 apenas para tornar o meio condutor e o indicador fenolftaleína, é eletrolisada com eletrodos inertes. Nesse processo observa-se desprendimento de gás:
a) de ambos os eletrodos e aparecimento de cor vermelha somente ao redor do eletrodo negativo.
b) de ambos os eletrodos e aparecimento de cor vermelha somente ao redor do eletrodo positivo.
c) somente do eletrodo negativo e aparecimento de cor vermelha ao redor do eletrodo positivo.
d) somente do eletrodo positivo e aparecimento de cor vermelha ao redor do eletrodo negativo.
e) de ambos os eletrodos e aparecimento de cor vermelha ao redor de ambos os eletrodos.
a) (0,200-0,100)×9,65×10-4/3,00
b) 0,200×9,65×10-4/3,00
c) (0,400-0,200)×9,65×10-4/3,00
d) (0,400+0,200)×9,65×10-4/3,00
e) 0,400×9,65×10-4/3,00
16) (UNITAU) Assinale a alternativa incorreta:
a) Eletrólise ígnea é a reação química provocada pela passagem de corrente elétrica através de um composto iônico fundido.
b) Eletrólise aquosa é a reação química provocada pela passagem de corrente elétrica por meio de uma solução aquosa de um eletrólito.
c) Com a eletrólise podemos produzir substâncias na indústria química como a soda cáustica e hipocloritos.
d) A ddp negativa indica que a reação é espontânea e que poderá ser usada para gerar corrente elétrica.
e) Na eletrólise de uma solução aquosa de KI, o íon iodeto, quando volta a ser átomo, perde um elétron.
17) (FUVEST) A eletrólise de cloreto de sódio fundido produz sódio metálico e gás cloro. Nesse processo, cada íon
a) sódio recebe dois elétrons.
b) cloreto recebe um elétron.
c) sódio recebe um elétron.
d) cloreto perde dois elétrons.
e) sódio perde um elétron.
18) (UNESP) O funcionamento de uma pilha de combustível é baseado nas semi-reações a seguir, cada uma delas representada com o respectivo potencial padrão de redução, E¡:2H2O(g) + 2e → H2(g) + 2OH(aq) E¡=-0,828 V_ O2(g)(g) + H2O(g) + 2e → 2OH(aq) E¡=0,401VLevando-se em conta estas informações, afirma-se:I) A reação global da pilha de combustível é H2(g) + _ O2(g)(g) → H2O(g) II) O hidrogênio sofre oxidação no processo. III) A diferença de potencial desta pilha de combustível, em condição padrão, é igual a 1,229V.Estão corretas as afirmações:
a) I, apenas.
b) II, apenas.
c) I e II, apenas.
d) II e III, apenas.
e) I, II e III.
19) (FUVEST) Para recuperar prata de soluções aquosas contendo íons Ag+, costuma-se adicionar zinco metálico às soluções, pois a transformação 2Ag+ + Zn¡ → 2Ag¡ + ZN2++é espontânea. Pode-se concluir então que:
a) o potencial de redução do Ag+/Ag¡ é maior do que o do ZN2++/Zn¡.
b) ocorre transferência de elétrons do Ag+ para Zn¡.
c) O Zn¡ atua como oxidante e o Ag+ como redutor.
d) o Zn¡ é menos redutor do que Ag¡.
e) ocorre a eletrólise do Ag+ e do Zn¡.
20) (FUVEST) Para pratear eletroliticamente um objeto de cobre e controlar a massa de prata depositada no objeto, foi montada a aparelhagem esquematizada na figura a seguir onde I, II e III são, respectivamente:
a) o objeto de cobre, uma chapa de platina e um amperímetro.
b) uma chapa de prata, o objeto de cobre e um voltímetro.
c) o objeto de cobre, uma chapa de prata e um voltímetro.
d) o objeto de cobre, uma chapa de prata e um amperímetro.
e) uma chapa de prata, o objeto de cobre e um amperímetro.

21) (CESGRANRIO) O esquema adiante representa uma célula voltáica com eletrodos de alumínio e cobalto. Observe a seguir as semi-reações e seus potenciais-padrão de redução:Ag+¤ + 3e→ Ag¡ (E¡ = -1,66V) Co+2 + 2e → Co¡ (E¡ = -0,28V)No caso de a célula estar em funcionamento, pode-se afirmar que: I - A força eletromotriz (F.E.M) da célula será 1,38 volts. II - O agente redutor da célula será o Ag¡. III - O agente oxidante da célula será o Co¡. IV - O fluxo de elétrons na célula se dará do eletrodo de alumínio para o cobalto. V - A solução de Co(NBaCO3)2 se concentrará.Assinale a opção que indica apenas as afirmativas corretas:
a) I e III.
b) II e III.
c) IV e V.
d) I, II e IV.
e) II, IV e V.
 22) (FATEC-SP) Obtém-se magnésio metálico por eletrólise do MgCl2 fundido. Nesse processo, a semi-reação que ocorre no cátodo é
22) (FATEC-SP) Obtém-se magnésio metálico por eletrólise do MgCl2 fundido. Nesse processo, a semi-reação que ocorre no cátodo é
a) Mg2+ + Mg2 → Mg.
b) Mg2+ - 2e → Mg.
c) 2Cg - 2e → Cl2.
d) Mg2+ + 2e → Mg.
e) 2Cg + 2e → Cl2.
a) I e III.
b) II e III.
c) IV e V.
d) I, II e IV.
e) II, IV e V.
 22) (FATEC-SP) Obtém-se magnésio metálico por eletrólise do MgCl2 fundido. Nesse processo, a semi-reação que ocorre no cátodo é
22) (FATEC-SP) Obtém-se magnésio metálico por eletrólise do MgCl2 fundido. Nesse processo, a semi-reação que ocorre no cátodo éa) Mg2+ + Mg2 → Mg.
b) Mg2+ - 2e → Mg.
c) 2Cg - 2e → Cl2.
d) Mg2+ + 2e → Mg.
e) 2Cg + 2e → Cl2.
23) (ITA) Durante uma eletrólise, a única reação que ocorreu no catodo foi a deposição de certo metal. Observou-se que a deposição de 8,81 gramas de metal correspondeu à passagem de 0,300mols de elétrons pelo circuito. Qual das opções a seguir contém o metal que pode ter sido depositado?Dados: Massas atômicas Ni = 58,71; Zn = 65,37; Ag = 107,87; Sn = 118,69; Pb = 207,19
a) Ni.b) Zn.
c) Ag.
d) Sn.
e) Pb.
24) (UEL) Em qual das seguintes reações NÃO há produção de hidrogênio, H2?
a) Oxidação do iodeto de hidrogênio pelo cloro.
b) Eletrólise da solução aquosa de ácido sulfúrico.
c) Oxidação do zinco pelo ácido clorídrico.
d) Eletrólise da água acidulada.
e) Hidrólise do hidreto de sódio.
25) (UEL) Nas reações de eletrólise para a obtenção de metais, as massas dos produtos depositados no cátodo podem ser calculados pela aplicação
a) do Princípio de Le Chatelier.
b) do Princípio da exclusão de Pauli.
c) das Regras de fases de Gibbs.
d) das leis de FaradaY2O3.
e) da Lei de Avogadro.
a) do Princípio de Le Chatelier.
b) do Princípio da exclusão de Pauli.
c) das Regras de fases de Gibbs.
d) das leis de FaradaY2O3.
e) da Lei de Avogadro.
26) (UFMG) A eletrólise da água acidulada é um processo que
a) 0,42 v Mn¡ + ZN2++ → MN2++ + Zn¡
b) 1,60 v MN2++ + Zn¡ → Mn¡ + ZN2++
c) 0,76 v MN2++ + Zn¡ → Mn¡ + ZN2++
d) 1,18 v Mn¡ + ZN2++ → MN2++ + Zn¡
e) 1,94 v MN2++ + Zn¡ → Mn¡ + Zn¡
a) envolve mudança de estado físico da água.
b) produz gases de baixa solubilidade em água.
c) produz iguais volumes de gases nos dois eletrodos.
d) separa os gases que constituem a água.
e) transforma os átomos constituintes da água.
27) (UFPR) Dados os potenciais de oxi-redução a seguir,Ag+ + 1e → Ag¡ E¡= +0,80V Fe2+ + 2e → Fe¡ E¡= -0,44V Ag+ + 3e → Ag¡ E¡= -1,66V Cu2 + 2e → Cu¡ E¡= +0,34Vé correto afirmar que;01) Uma pilha formada por um eletrodo de ferro em contato com uma solução contendo íons Fe2+, e um eletrodo de prata em contato com uma solução contendo íons Ag+, ligados por uma ponte salina, apresenta um potencial padrão de +1,24V. 02) Na mesma pilha da alternativa anterior ocorrerá a oxidação da prata com formação de Ag+. 04) A reação 2Ag¡ + Fe2+ → 2Ag+ + Fe¡ é espontânea. 08) Uma lâmina de alumínio mergulha em uma solução 1mol/L de CuSO4 apresentará a formação de um depósito de cobre metálico dobre ela. 16) O alumínio (Ag¡) é um redutor mais forte do que o ferro (Fe¡).
Soma = ( )
28) (FAAP) A pilha alcalina apresenta vantagens sobre uma pilha de Leclanché (zinco-carvão). Considerando que uma pilha alcalina seja constituída por uma barra de manganês puro, outra de zinco poroso e uma pasta contendo KOH, a ddp inicial da pilha e a equação global da reação que nela ocorre, são: Dados: MN2++ + 2e → Mn¡ E¡ = -118v ZN2++ + 2e → Zn¡ E¡ = -0,76v
a) 0,42 v Mn¡ + ZN2++ → MN2++ + Zn¡
b) 1,60 v MN2++ + Zn¡ → Mn¡ + ZN2++
c) 0,76 v MN2++ + Zn¡ → Mn¡ + ZN2++
d) 1,18 v Mn¡ + ZN2++ → MN2++ + Zn¡
e) 1,94 v MN2++ + Zn¡ → Mn¡ + Zn¡
29) (FAAP) Industrialmente, a soda cáustica (NaOH) é obtida por eletrólise de uma solução aquosa de cloreto de sódio. Durante essa eletrólise, obtém-se como sub-produtos:
a) zinco metálico e água.
b) dióxido de manganês e água.
c) sais de amônio e de zinco.
d) zinco metálico e dióxido de manganês.
e) amônia, água, sais de zinco e óxido de manganês III.
a) hidrogênio e cloro no ânodo
b) somente hidrogênio no ânodo
c) somente cloro no cátodo
d) hidrogênio e cloro no cátodo
e) somente cloro no ânodo
30) (UFC) A cidade de Fortaleza possui a segunda atmosfera mais agressiva do mundo relativa ao processo de corrosão. Isto tem motivado a realização de pesquisas nos departamentos de química da UFC. Fatores como alta taxa de insolação, velocidade dos ventos, maresia e alto teor de umidade contribuem para este fenômeno. Na formação da ferrugem ocorrem as seguintes reações:2Fe(s) → 2Fe2+(aq) + 4e E° = + 0,44 V2H2O(g) + O2(g) + 4e → 4OH(aq) E° = + 0,40 VAssinale as alternativas corretas:01. A reação catódica é uma reação de oxidação que libera elétrons, proporcionando a corrosão do metal. 02. O processo total de corrosão do ferro, apresentado anteriormente, é espontâneo e tem potencial de +0,84V. 04. O alto teor de umidade associado à maresia facilita a formação do eletrólito. 08. A ocorrência na atmosfera de poluentes industriais, tal como o SO2contribui para a aceleração da corrosão pela possibilidade da presença do ácido sulfúrico na superfície do metal. 16. Metais com potenciais padrão de redução mais negativos do que o do Ferro são indicados para serem utilizados como eletrodos de sacrifício, isto é, se oxidam preferencialmente ao ferro.
Soma ( )
31) (UFRS) Na eletrólise de nitrato de ferro II, em solução aquosa, ocorre
a) redução no pólo negativo com formação de ferro metálico.
b) oxidação no pólo negativo com liberação de gás oxigênio.
c) redução no pólo positivo com liberação de gás oxigênio.
d) oxidação no pólo positivo com formação de gás NO2.
e) redução no pólo negativo com formação de gás hidrogênio.
32) (PUCCAMP) Nas pilhas secas, geralmente utilizadas em lanternas, há um envoltório de zinco metálico e um bastão central de grafite rodeado de dióxido de manganês e pasta úmida de cloreto de amônio e de zinco, conforme a figura a seguir. As reações são complexas, porém quando o fluxo de corrente é pequeno, podem ser representadas por:Ânodo: Zn (s) → 2e + ZN2++Cátodo: 2MnO2(s) + 2NH+4 + 2e → MN2+BaCO3(s) + 2NH3 + H2OÀ medida que a pilha seca vai sendo gasta há aumento nas massas de:
a) zinco metálico e água.
b) dióxido de manganês e água.
c) sais de amônio e de zinco.
d) zinco metálico e dióxido de manganês.
e) amônia, água, sais de zinco e óxido de manganês III.
33) (FGV) Na obtenção do alumínio a partir da bauxita, Ag2BaCO3, uma das reações envolvidas éAg¤+(g) + 3e → Ag(s)Acerca desse processo, quais termos devem substituir corretamente x e Y2O3 na afirmação a seguir? "Em escala industrial, o alumínio pode ser obtido pela (x) do Ag2BaCO3 e nesse processo ocorre (Y2O3) dos íons Ag¤+."
a) (x) hidrólise, (Y2O3) solvatação
b) (x) eletrólise, (Y2O3) redução
c) (x) decomposição térmica, (Y2O3) oxidação
d) (x) pirólise, (Y2O3) oxidação
e) (x) eletrólise, (Y2O3) hidratação.
a) (x) hidrólise, (Y2O3) solvatação
b) (x) eletrólise, (Y2O3) redução
c) (x) decomposição térmica, (Y2O3) oxidação
d) (x) pirólise, (Y2O3) oxidação
e) (x) eletrólise, (Y2O3) hidratação.
34) (UEL) Na eletrólise de uma solução aquosa diluída de um certo eletrólito verifica-se a decomposição da água, com formação de 20 mililitros de hidrogênio. Nessas condições, quantos mililitros de oxigênio são obtidos? a) 40
b) 20
c) 15
d) 10
e) 0,5
c) 15
d) 10
e) 0,5
35) (FEI) O gás cloro pode ser obtido pela eletrólise da água do mar ou pela eletrólise ígnea do cloreto de sódio. Assinale a afirmativa correta com relação a esses dois processos:
a) ambos liberam Cl2 gasoso no catodo
b) ambos envolvem transferência de 2 elétrons por mol de sódio
c) ambos liberam H2 no catodo
d) ambos liberam Na metálico no catodo
e) um libera H2 e outro Na metálico no catodo.
a) ambos liberam Cl2 gasoso no catodo
b) ambos envolvem transferência de 2 elétrons por mol de sódio
c) ambos liberam H2 no catodo
d) ambos liberam Na metálico no catodo
e) um libera H2 e outro Na metálico no catodo.
36) (CESGRANRIO) Considere a pilha representada abaixo: Cu (s) ¦ Cu2 ¦¦ Fe¤+, Fe2+ ¦ Pt (s)Assinale a afirmativa falsa:
a) A reação de redução que ocorre na pilha é Cu2 + 2e → Cu (s);
b) O eletrodo de cobre é o anodo;
c) A semi-reação que ocorre no catodo é Fe¤+→ Fe2+ + e;
d) A reação total da pilha é 2 Fe¤+ + Cu (s) → 2 Fe2+ + Cu2;
e) Os elétrons migram do eletrodo de cobre para o eletrodo de platina.
37) (UECE) Assinale a alternativa correta:
a) na eletrólise de uma solução aquosa de NaCg, a solução torna-se ácida devido à formação de HCg
b) na eletrólise de uma solução aquosa de sulfato de cobre, CuSO4, devem-se fornecer 2 mols de elétrons para que haja deposição de 63,5g de cobre metálico
c) na eletrólise de uma solução aquosa de ácido clorídrico, HCg, ocorre oxidação anódica de H+(aq)
d) eletrólise é um fenômeno que ocorre espontaneamente e produz corrente elétrica.
a) na eletrólise de uma solução aquosa de NaCg, a solução torna-se ácida devido à formação de HCg
b) na eletrólise de uma solução aquosa de sulfato de cobre, CuSO4, devem-se fornecer 2 mols de elétrons para que haja deposição de 63,5g de cobre metálico
c) na eletrólise de uma solução aquosa de ácido clorídrico, HCg, ocorre oxidação anódica de H+(aq)
d) eletrólise é um fenômeno que ocorre espontaneamente e produz corrente elétrica.
38) (PUC-MG) Considere a célula eletroquímica, representada pela equação global: Ni + Cu+2 → Ni+2 + CuÉ CORRETO afirmar que:
a) há desgaste do eletrodo de cobre.
b) o cobre sofre oxidação.
c) o níquel funciona como anodo.
d) a solução de níquel irá diluir-se.
e) os elétrons fluem, pelo circuito externo, do cobre para o níquel.
a) há desgaste do eletrodo de cobre.
b) o cobre sofre oxidação.
c) o níquel funciona como anodo.
d) a solução de níquel irá diluir-se.
e) os elétrons fluem, pelo circuito externo, do cobre para o níquel.
39) (MACKENZIE) Zn + HgO + 2KOH → K2ZnO2 + Hg + H2OA equação anterior representa a reação que ocorre num certo tipo de pilha. Podemos concluir que:
a) o Zn atua como oxidante.
b) o mercúrio, no óxido de mercúrio II, sofre oxidação, recebendo dois elétrons.
c) o potencial de redução do ZN2++ / Zn é menor que o do Hg2+ / Hg.
d) o hidróxido de potássio atua como redutor.
e) o número de elétrons envolvidos na redução e na oxidação não é o mesmo.
a) o Zn atua como oxidante.
b) o mercúrio, no óxido de mercúrio II, sofre oxidação, recebendo dois elétrons.
c) o potencial de redução do ZN2++ / Zn é menor que o do Hg2+ / Hg.
d) o hidróxido de potássio atua como redutor.
e) o número de elétrons envolvidos na redução e na oxidação não é o mesmo.
40) (UNIRIO) O esquema a seguir representa a pilha ferro-hidrogênio (eletrodo padrão). O voltímetro indica a força eletromotriz em condições-padrão. O anodo desta pilha e o potencial padrão de redução do ferro são, respectivamente:
a) eletrodo de ferro e - 0,44V
b) eletrodo de ferro e + 0,22V
c) eletrodo de ferro e + 0,44V
d) eletrodo de hidrogênio e - 0,44V
e) eletrodo de hidrogênio e + 0,44V
a) eletrodo de ferro e - 0,44V
b) eletrodo de ferro e + 0,22V
c) eletrodo de ferro e + 0,44V
d) eletrodo de hidrogênio e - 0,44V
e) eletrodo de hidrogênio e + 0,44V
41) (UNESP) Sódio metálico e cloro gasoso são obtidos industrialmente pela passagem de corrente elétrica por NaCg fundido. Este processo de decomposição denomina-se
a) 1,14 V
b) 0,46 V
c) 1,26 V
d) 1,94 V
e) 0,16 V
a) osmose.
b) eletrólise.
c) hidrólise.
d) pirólise.
e) corrosão.
42) (UFF) Em uma pilha galvânica, um eletrodo é cobre imerso em solução de Cu2 1,0M e o outro é prata imerso em solução de Ag1+ 1,0 M. Dados: potenciais-padrão de redução a 25°CCu2+ 2 e →Cu° E¡ = 0,34 VAg+ + 1 e →Ag° E¡ = 0,80 VO potencial padrão da célula para esta pilha é:
a) 1,14 V
b) 0,46 V
c) 1,26 V
d) 1,94 V
e) 0,16 V
43) (UFMG) Pilhas a combustível são dispositivos eletroquímicos em que a reação de um combustível com oxigênio produz energia elétrica. O diagrama representa, simplificadamente, uma pilha a combustível, que envolve a reação entre os gases hidrogênio e oxigênio, conforme a equação 2 H2 (g) + O2 (g) → 2 H2O (g) Com relação a essa pilha, todas as afirmativas a seguir estão corretas, EXCETO
a) O circuito externo transporta, para o oxigênio, elétrons retirados do hidrogênio.
b) O transporte de carga através da solução é feito por íons.
c) A reação torna iguais os números de oxidação do hidrogênio e do oxigênio.
d) O hidrogênio atua na reação como o agente redutor.
a) O circuito externo transporta, para o oxigênio, elétrons retirados do hidrogênio.
b) O transporte de carga através da solução é feito por íons.
c) A reação torna iguais os números de oxidação do hidrogênio e do oxigênio.
d) O hidrogênio atua na reação como o agente redutor.
44) (UERJ) Considere a célula eletrolítica abaixo: Eletrolisando-se, durante 5 minutos, a solução de CuSO4 com uma corrente elétrica de 1,93 ampere, verificou-se que a massa de cobre metálico depositada no cátodo foi de 0,18 g. Em função dos valores apresentados acima, o rendimento do processo foi igual a: Dado: Massa molar do Cu = 63,5 g/mol
a) 94,5 %
b) 96,3 %
c) 97,2 %
d) 98,5 %
b) em ambas as pilhas, o Zn (s) é o agente redutor.
c) na pilha alcalina, a reação de oxirredução se dá em meio básico.
d) na pilha comum, o íon NH4+ (aq) é a espécie que recebe elétrons.
a) 94,5 %
b) 96,3 %
c) 97,2 %
d) 98,5 %
45) (UEL) Considere a seguinte seqüência: Uma pessoa, por descuido, mastigou com um dente que tinha obturação com amálgama, um pedaço de papel alumínio que recobria um bombom de chocolate e sentiu sensação de "choque elétrico". Essa sensação pode ter acontecido devido à ocorrência de uma reação de
a) pilha eletroquímica, na qual a amálgama sofre oxidação.
b) pilha eletroquímica, na qual o alumínio sofre oxidação.
c) pilha eletroquímica, na qual a água da saliva sofre oxidação.
d) eletrólise, na qual o alumínio é o cátodo.
e) eletrólise, na qual a água da saliva é o ânodo.
46) (UNIRIO) "(CH) a aviação de Saddam Husseim bombardeou durante 48h (CH) a aldeia curda de Albeja, com dois terríveis gases: o cianeto de hidrogênio e o gás mostarda." O Globo, 05/07/98.O cianeto de hidrogênio é reativo e letal. Ele reage com um determinado elemento X da seguinte forma: X + HCN → XCN + H2Se você tiver uma solução que contém uma mistura dos cátions que constam da tabela abaixo, qual dos elementos irá reagir primeiro com o HCN? Dados: E°(V) Fe2+(aq) + 2e →Fe(s) -0,44ZN2++(aq) + 2e →Zn(s) -0,76Pb2+(aq) + 2e →Pb(s) -0,13Pd2+(aq) + 2e →Pd(s) +0,99Cu2(aq) + 2e →Cu(s) +0,342H+(aq) + 2e →H2(g) 0,00
a) Fe
b) Pd
c) Zn
d) Pb
e) Cu
a) pilha eletroquímica, na qual a amálgama sofre oxidação.
b) pilha eletroquímica, na qual o alumínio sofre oxidação.
c) pilha eletroquímica, na qual a água da saliva sofre oxidação.
d) eletrólise, na qual o alumínio é o cátodo.
e) eletrólise, na qual a água da saliva é o ânodo.
46) (UNIRIO) "(CH) a aviação de Saddam Husseim bombardeou durante 48h (CH) a aldeia curda de Albeja, com dois terríveis gases: o cianeto de hidrogênio e o gás mostarda." O Globo, 05/07/98.O cianeto de hidrogênio é reativo e letal. Ele reage com um determinado elemento X da seguinte forma: X + HCN → XCN + H2Se você tiver uma solução que contém uma mistura dos cátions que constam da tabela abaixo, qual dos elementos irá reagir primeiro com o HCN? Dados: E°(V) Fe2+(aq) + 2e →Fe(s) -0,44ZN2++(aq) + 2e →Zn(s) -0,76Pb2+(aq) + 2e →Pb(s) -0,13Pd2+(aq) + 2e →Pd(s) +0,99Cu2(aq) + 2e →Cu(s) +0,342H+(aq) + 2e →H2(g) 0,00
a) Fe
b) Pd
c) Zn
d) Pb
e) Cu
47) (MACKENZIE) Na proteção contra a ferrugem, em tanques de aço, são usadas placas de um certo metal, chamado de metal de sacrifício. Esse metal, que deve ser periodicamente substituído, pode ser:
a) o cobre.
b) o magnésio.
c) a prata.
d) o ouro.
e) a platina.

a) o cobre.
b) o magnésio.
c) a prata.
d) o ouro.
e) a platina.

48) (UFU) Pilhas são sistemas geradores de corrente elétrica. De acordo com o esquema da pilha, apresentado a seguir, é possível afirmar que I - a direção espontânea do sistema é Zn(s)→Zn++(aq) e Cu++(aq)→Cu(s). II - o fluxo de elétrons será da semicélula I para a II. III - os cátions se dirigirão da ponte salina para a semicélula I. IV - à medida que a pilha funciona, a concentração de íons Zn++ em mols /L, decresce.Assinale a alternativa correta:
a) Apenas as afirmativas I, II e III são verdadeiras.
b) Apenas as afirmativas I e II são verdadeiras.
c) Apenas as afirmativas I, III e IV são verdadeiras.
d) Apenas as afirmativas II e IV são verdadeiras.
e) Todas as afirmativas são verdadeiras.
a) Apenas as afirmativas I, II e III são verdadeiras.
b) Apenas as afirmativas I e II são verdadeiras.
c) Apenas as afirmativas I, III e IV são verdadeiras.
d) Apenas as afirmativas II e IV são verdadeiras.
e) Todas as afirmativas são verdadeiras.
49) (UFMG) A principal diferença entre as pilhas comuns e as alcalinas consiste na substituição, nestas últimas, do cloreto de amônio pelo hidróxido de potássio. Assim sendo, as semi-reações que ocorrem podem ser representadas,- no caso das pilhas comuns, por cátodo: 2MnO2(s)+2NH4+(aq)+2e→MN2+BaCO3(s)+2NH3(aq)+H2O(g) ânodo: Zn(s) → ZN2++(aq) + 2e - no caso das pilhas alcalinas, por cátodo: 2MnO2(s)+H2O(g)+2e → MN2+BaCO3(s)+2OH(aq) ânodo: Zn(s) + 2 OH(aq) → Zn(OH)2(s) + 2e Considerando-se essas informações, é INCORRETO afirmar que,
a) em ambas as pilhas, a espécie que perde elétrons é a mesma.b) em ambas as pilhas, o Zn (s) é o agente redutor.
c) na pilha alcalina, a reação de oxirredução se dá em meio básico.
d) na pilha comum, o íon NH4+ (aq) é a espécie que recebe elétrons.
50) (UNESP) Em maio de 1800, Alessandro Volta anunciou a invenção da pilha elétrica, a primeira fonte contínua de eletricidade. O seu uso influenciou fortemente o desenvolvimento da Química nas décadas seguintes. A pilha de Volta era composta de discos de zinco e de prata sobrepostos e intercalados com material poroso embebido em solução salina, como mostrado a seguir. Com o funcionamento da pilha, observa-se que os discos de zinco sofrem corrosão.A respeito da pilha de Volta, são feitas as seguintes afirmações:I - Nos discos de zinco ocorre a semi-reação: Zn(s) → ZN2++ + 2 e. II - Os discos de prata são fontes de elétrons para o circuito externo. III - O aumento do diâmetro dos discos empregados na montagem não influencia na tensão fornecida pela pilha.Das três afirmações apresentadas,
a) apenas I é verdadeira.
b) apenas II é verdadeira.
c) apenas I e II são verdadeiras.
d) apenas I e III são verdadeiras.
e) apenas II e III são verdadeiras.
a) apenas I é verdadeira.
b) apenas II é verdadeira.
c) apenas I e II são verdadeiras.
d) apenas I e III são verdadeiras.
e) apenas II e III são verdadeiras.
51) (PUCCAMP) Se, na aula sobre eletrólise, um aluno tiver que exemplificar um produto que é, industrialmente, obtido por tal processo, poderá citar.
I.a soda cáustica
II.o ferro
III.o alumínio
II.o ferro
III.o alumínio
Desses exemplos, SOMENTE
a) I é correto.
b) II é correto.
c) III é correto.
d) I e III são corretos.
e) II e III são corretos.
a) I é correto.
b) II é correto.
c) III é correto.
d) I e III são corretos.
e) II e III são corretos.
52) (PUC-PR) Na eletrólise aquosa do Na2SO4(aq), com eletrodos inertes, obteremos no ânodo e no cátodo, respectivamente?
a) H2(g) e SO2(g)
b) Na(s) e SO2(g)
c) O2(g) e Na(s)
d) Na(s) e O2(g)
e) O2(g) e H2(g)
a) H2(g) e SO2(g)
b) Na(s) e SO2(g)
c) O2(g) e Na(s)
d) Na(s) e O2(g)
e) O2(g) e H2(g)
53) (UFSCAR) Filtros de piscinas, construídos em ferro, são muito afetados pela corrosão. No processo de corrosão ocorre a dissolução lenta do metal, com a formação de íons Fe2+ em solução aquosa. Para a proteção dos filtros são utilizados os chamados "eletrodos de sacrifício". Estes eletrodos são barras de metais convenientemente escolhidos que, colocados em contato com o filtro, sofrem corrosão no lugar do ferro. Com base nos dados a seguir pode-se prever que são "eletrodos de sacrifício" adequados barras de
a) magnésio, apenas.
b) cobre, apenas.
c) níquel, apenas.
d) cobre e níquel, apenas.
e) cobre, níquel e magnésio.
54) (UFRN) Niquelação é o processo de deposição eletrolítica de níquel numa superfície metálica, com a finalidade de protegê-la contra a corrosão. Esse procedimento consiste em mergulhar, em uma solução contendo íons Ni2+, a peça a ser recoberta, e conectá-la, como cátodo, a uma corrente contínua e constante, medindo o tempo.Após a passagem de 50mA de corrente elétrica por uma peça, durante 193 segundos, a massa de níquel metálico depositada será:Massa Molar: Ni = 58,7 g/mol
a) 5,8 mg
b) 2,9 g
c) 2,9 mg
d) 5,8 g
a) 5,8 mg
b) 2,9 g
c) 2,9 mg
d) 5,8 g
55) (UFPI) Galvanização é um dos processos industriais mais utilizados na proteção à corrosão de materiais metálicos, e se processa por meio eletrolítico. Em materiais ferrosos como pregos e parafusos, por exemplo, são eletrodepositados íons de zinco. Analise as afirmativas que se seguem sobre o processo acima descrito e marque a opção correta.
I.A eletrodeposição é um processo espontâneo.
II.No par zinco-prego exposto em meio agressivo, o zinco atua como cátodo.
III.Durante a eletrólise, a massa de zinco eletrodepositada no prego é proporcional à carga elétrica.
a) Apenas I está correta.
b) I e II estão corretas.
c) Apenas II está correta.
d) II e III estão corretas.
e) Apenas III está correta.
I.A eletrodeposição é um processo espontâneo.
II.No par zinco-prego exposto em meio agressivo, o zinco atua como cátodo.
III.Durante a eletrólise, a massa de zinco eletrodepositada no prego é proporcional à carga elétrica.
a) Apenas I está correta.
b) I e II estão corretas.
c) Apenas II está correta.
d) II e III estão corretas.
e) Apenas III está correta.
56) (UFJF) A Vitamina C, ácido ascórbico, presente em grande concentração nos frutos cítricos, é essencial para os seres humanos. Suas propriedades redutoras (ou anti-oxidantes) são bastante conhecidas e podem ser evidenciadas através de sua reação com iodo (I2). A solução de iodo, de coloração castanha, torna-se incolor após a adição de suco de limão, devido à formação de íon iodeto. Assinale a alternativa que apresenta a afirmativa ERRADA:
a) A reação de redução do iodo pode ser representada por I2+2e→2I.
b) O iodo tem maior potencial normal de redução do que a vitamina C.
c) A vitamina C oxida o iodo a iodeto.
d) O caráter redutor da vitamina C deve ser maior do que o caráter redutor do iodo.
e) A vitamina C perde elétrons na reação mencionada.
a) A reação de redução do iodo pode ser representada por I2+2e→2I.
b) O iodo tem maior potencial normal de redução do que a vitamina C.
c) A vitamina C oxida o iodo a iodeto.
d) O caráter redutor da vitamina C deve ser maior do que o caráter redutor do iodo.
e) A vitamina C perde elétrons na reação mencionada.
57) (UFPE) A eletrólise de cloreto de sódio fundido produz sódio metálico e gás cloro. Nesse processo, cada íon:
a) sódio recebe dois elétrons.
b) cloreto recebe dois elétrons.
c) sódio recebe um elétron.
d) cloreto perde dois elétrons.
e) sódio perde um elétron.
a) sódio recebe dois elétrons.
b) cloreto recebe dois elétrons.
c) sódio recebe um elétron.
d) cloreto perde dois elétrons.
e) sódio perde um elétron.
58) (UFPI) Pesquisas têm mostrado que os resíduos de dessalinizadores contêm alto teor de cloreto (Cl) que podem, por processo industrial eletroquímico, usando uma fonte de corrente elétrica, gerar cloro (Cl2) para desinfecção de água de abastecimento. A reação direta no sistema acontece conforme segue-se:2Cl(aq) + 2H2O(l) → Cl2(g) + H2(g) + 2OH(aq)Analise as afirmativas quanto ao processo eletroquímico e marque a opção correta.
a) O processo industrial é de natureza galvânica.
b) O cloro é obtido no cátodo.
c) Os elétrons fluem do cátodo para o ânodo.
d) O cloro é obtido da reação de oxidação.
e) A reação secundária de formação do hidrogênio acontece no ânodo.
a) O processo industrial é de natureza galvânica.
b) O cloro é obtido no cátodo.
c) Os elétrons fluem do cátodo para o ânodo.
d) O cloro é obtido da reação de oxidação.
e) A reação secundária de formação do hidrogênio acontece no ânodo.
59) (UFRS) A força eletromotriz de uma célula eletroquímica depende
a) da natureza dos eletrodos.
b) do tamanho dos eletrodos.
c) da distância entre os eletrodos.
d) da forma dos eletrodos.
e) do volume de solução eletrolítica.
60) (Fuvest-SP) Deixando funcionar uma pilha formada por uma barra de chumbo imersa em uma solução de Pb(NO3)2 e uma barra de zinco imersa em uma solução de Zn(NO3)2separadas por uma parede porosa, após algum tempo a barra de zinco vai se desgastando e a de chumbo ficando mais espessa, em consequência da deposição de átomos neutros no início do de chumbo do experimento, as duas barras apresentavam as mesmas dimensões e o espessamento da barra de chumbo. Qual o sentido do fluxo de elétrons no fio metálico.
Gabarito:
a) da natureza dos eletrodos.
b) do tamanho dos eletrodos.
c) da distância entre os eletrodos.
d) da forma dos eletrodos.
e) do volume de solução eletrolítica.
60) (Fuvest-SP) Deixando funcionar uma pilha formada por uma barra de chumbo imersa em uma solução de Pb(NO3)2 e uma barra de zinco imersa em uma solução de Zn(NO3)2separadas por uma parede porosa, após algum tempo a barra de zinco vai se desgastando e a de chumbo ficando mais espessa, em consequência da deposição de átomos neutros no início do de chumbo do experimento, as duas barras apresentavam as mesmas dimensões e o espessamento da barra de chumbo. Qual o sentido do fluxo de elétrons no fio metálico.
Gabarito:
1) D 2) E 3) B 4) B 5) C 6) E 7) A 8) B 9) C 10) E 11) E
12)
a) O eletrodo A está sofrendo redução, porque está ganhando elétrons, portanto, seu Nox (Número de Oxidação) irá diminuir. Já o eletrodo B está sofrendo oxidação, porque está perdendo elétrons e seu Nox irá aumentar.
b) O eletrodo A é o cátodo e o B é o ânodo.
c) Semirreação do ânodo: B(s) + 3 e- → B3+(aq)
Semirreação do cátodo: A2+(aq) → A(s) + 2 e-
Para encontrar a equação que representa a reação global dessa pilha, teremos que multiplicar a semirreação do ânodo por 2 e a do cátodo por 3, para poder igualar os elétrons que foram transferidos e recebidos nos eletrodos:
Semirreação do ânodo: 2 B(s) + 6 e- → 2 B3+(aq)
Semirreação do cátodo: 3 A2+(aq) → 3 A(s) + 6 e-
Reação Global: 2 B(s) +3 A2+(aq) → 2 B3+(aq)+ 3 A(s)
d) Conforme mostra a reação global, a concentração de B3+ aumenta e de A2+ diminui.
e) Haverá deposição sobre o eletrodo A e corrosão do eletrodo B.
13) Alternativa “e”.
b) O eletrodo A é o cátodo e o B é o ânodo.
c) Semirreação do ânodo: B(s) + 3 e- → B3+(aq)
Semirreação do cátodo: A2+(aq) → A(s) + 2 e-
Para encontrar a equação que representa a reação global dessa pilha, teremos que multiplicar a semirreação do ânodo por 2 e a do cátodo por 3, para poder igualar os elétrons que foram transferidos e recebidos nos eletrodos:
Semirreação do ânodo: 2 B(s) + 6 e- → 2 B3+(aq)
Semirreação do cátodo: 3 A2+(aq) → 3 A(s) + 6 e-
Reação Global: 2 B(s) +3 A2+(aq) → 2 B3+(aq)+ 3 A(s)
d) Conforme mostra a reação global, a concentração de B3+ aumenta e de A2+ diminui.
e) Haverá deposição sobre o eletrodo A e corrosão do eletrodo B.
13) Alternativa “e”.
a) O zinco metálico é o ânodo, ele perde elétrons: Zn(s) → Zn2+(aq) + 2e-.
b) O íon cobre sofre redução, ele ganha elétrons: Cu2+(aq) + 2 e-→ Cu(s).
b) O íon cobre sofre redução, ele ganha elétrons: Cu2+(aq) + 2 e-→ Cu(s).
c) O zinco metálico é o ânodo que é corroído, porque ele sofre oxidação e, com isso, a massa da barra diminui.
d) O cobre é o agente oxidante, pois ele causou a oxidação do zinco.
e) Correta.
14) A 15) E 16) D 17) C 18) E 19) A 20) E 21) D 22) D 23) A 24) A 25) D
26) B 27) 01 + 08 + 16 = 25 28) A 29) E 30) 02 + 04 + 08 + 16 = 30 31) A 32) E
33) B 34) D 35) E 36) A 37) B 38) C 39) C 40) A 41) B 42) B 43) C 44) A
45) B 46) C 47) B 48) B 49) D 50) D 51) D 52) E 53) A 54) C 55) E 56) C
57) C 58) D 59) A 60) O espessamento da barra de chumbo, implica em ganho de massa e portanto ganho de elétrons ,ou seja redução; portanto o desgaste da barra de zinco implica em perda de elétrons , ou seja , em oxidação.
Eletroquímica e pilhas - resumo
Reações químicas podem produzir correntes elétricas e correntes elétricas podem produzir reações químicas
de óxido-redução. Temos então:
A. Pilhas, baterias e acumuladores - são dispositivos que produzem corrente elétrica por intermédio de uma reação espontânea de óxido-redução.
B. Eletrólise - é o processo de obtenção de uma reação de óxido-redução por meio de uma corrente elétrica.
A. Pilhas - existem vários tipos de pilhas e baterias, mas por motivos didáticos adota-se, normalmente, o esquema exemplo abaixo, chamada de pilha de Daniell:


No anodo ocorre a oxidação.
Por convenção internacional a reação de uma pilha é:


2. Determinação do potencial de redução
3. Maior potencial de redução


Por exemplo, em uma pilha de alumínio e cobre:

Eletrólise ígnea - é feite na ausência de água, com a substância pura no estado líquido (fundida). Por exemplo, a eletrólise do cloreto de sódio (NaCl) que produz sódio metálico (Na) e cloro (Cl2) na forma de gás, utilizando eletrodos de platina:





e:





Cada átomo de Zn0 que manda dois elétrons para o circuito externo sai da placa e passa para a solução na forma de Zn2+, provocando a corrosão da placa e fazendo a solução ficar mais concentrada de íons zinco. Isso tende a fazer com que essa solução fique com excesso de cargas positivas (os íons sulfato, SO2-, não participam da reação). Simultaneamente, a outra solução fica menos concentrada em íons Cu2+ e tende a ter acúmulo de cargas negativas.
Se isso ocorresse, o funcionamento da pilha rapidamente iria cessar, pois o acúmulo de carga positiva na solução da esquerda iria atrair os elétrons do fio metálico para a placa de zinco (cargas de sinais opostos se atraem), e o acúmulo de carga negativa na solução da direita iria repelir os elétrons do fio metálico (cargas de mesmo sinal se repelem), impedindo-os de chegar à placa de cobre.
O acúmulo de cargas elétricas nas soluções é evitado pela ponte salina, um tubo de vidro recurvado preenchido com material gelatinoso e contendo alta concentração de um sal que não interfira no processo; KCl, por exemplo.
O excesso de cátions (portadores de cargas positivas) no frasco da esquerda é compensado pela migração de íons Cl- provenientes da ponte salina em direção ao frasco da esquerda. E o excesso de ânions (portadores de cargas negativas) no frasco da direita é compensado pela migração de íons K+ provenientes da ponte salina em direção ao frasco da direita. Assim, a presença da ponte salina permite que a pilha continue funcionando.
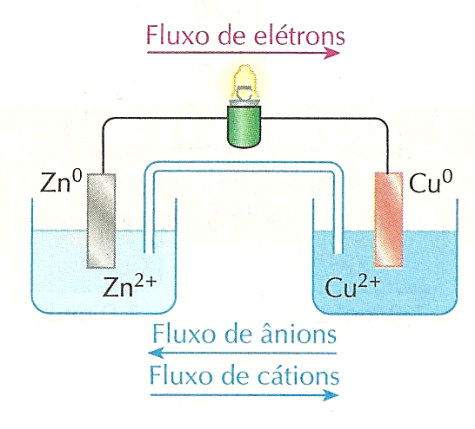
De fato, caso a ponte salina seja retirada, verifica-se que a lâmpada apaga imediatamente. Isso porque o excesso de íons acumulados nas soluções rapidamente impede o fluxo de elétrons através da parte metálica do circuito. É importante perceber que o circuito elétrico inclui o interior da pilha, porém não é um condutor metálico que conduz a corrente dentro dela, mas sim outro tipo de condutor elétrico: soluções aquosas.
As soluções de ambos os frascos e também a solução presente na ponte salina permitem que o circuito elétrico esteja totalmente fechado. Lembre-se de que corrente elétrica é um fluxo ordenado decargas elétricas. No fio metálico, são os elétrons (portadores de carga elétrica negativa) que se movimentam. Nas soluções não são elétrons que se movimentam, mas sim cátions e ânions.
Assim, a experiência de acender uma lâmpada com uma pilha de Daniell envolve um circuito elétrico fechado que consiste basicamente de duas partes: uma parte externa à pilha, formada por fios metálicos, e uma parte interna à pilha, na qual a corrente elétrica que atravessa as soluções aquosas é um fluxo ordenado de cátions e ânions.
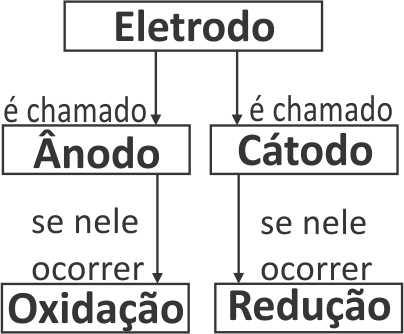
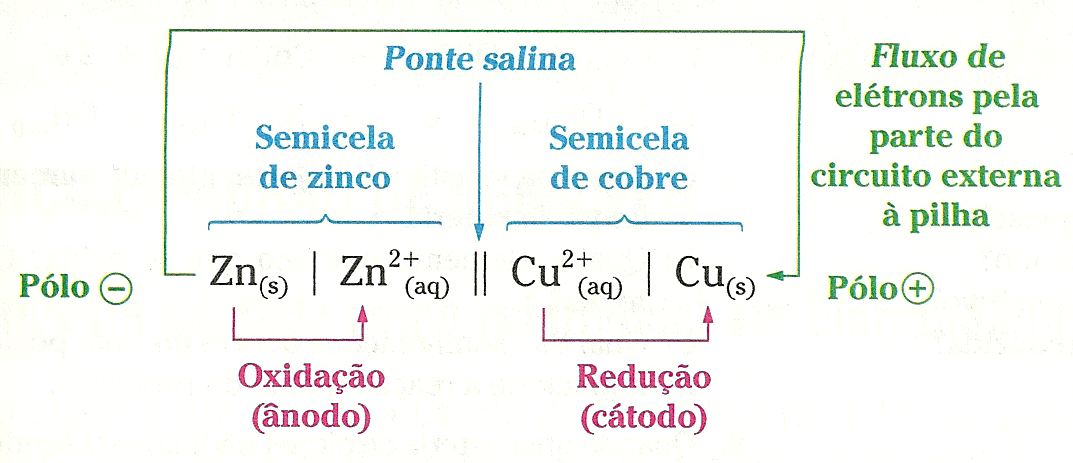
As placas metálicas existentes em uma pilha, que fazem a sua conexão com a parte do circuito elétrico externa à pilha, são denominadas eletrodos. É também frequente, em Química, encontrarmos a palavra eletrodo sendo usada como sinônimo não apenas da placa metálica, mas de toda a semicela.
Para todas as celas eletroquímicas, vale a seguinte convenção:
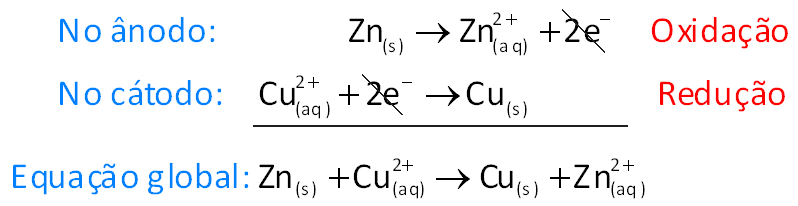
A União Internacional de Química Pura e Aplicada (IUPAC) propôs uma maneira esquemática para representar uma cela galvânica. Tal representação é bastante útil, pois permite descrever de modo rápido e simples esse tipo de dispositivo sem a necessidade de desenhá-lo.
Vamos exemplificar essa representação para a pilha de Daniell:
Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
A barra vertical simples (|) indica a fronteira que separa duas fases, e a barra vertical dupla (||) indica a ponte salina. Do lado esquerdo é representada a semicela em que ocorre a oxidação (ânodo) e, do lado direito, a semicela em que ocorre a redução (cátodo).
Assim:
A fim de poderem comparar as diversas semicelas, os químicos resolveram medir e tabelar as diferenças de potencial de todas elas em relação a um único referencial.
O referencial escolhido para expressar potencial elétrico, em experimentos de Eletroquímica, é o eletrodo-padrão de hidrogênio.
Evidências mostraram aos cientistas que a platina (metal nobre, que dificilmente reage com outras substâncias) tem a propriedade de adsorver o gás hidrogênio, ou seja, de reter em sua superfície as moléculas desse gás.
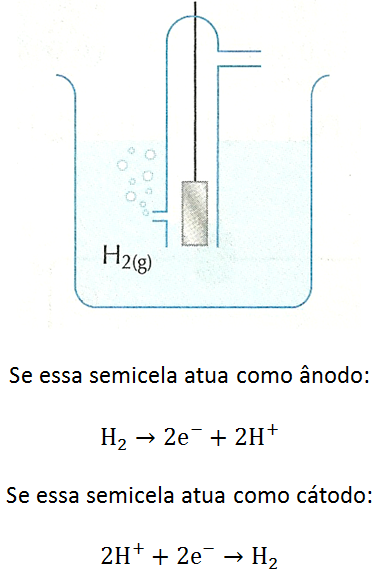 Ao usar a semicela H+/H2, a placa de platina serve como elemento metálico capaz de receber elétrons vindos do circuito externo ou enviar elétrons para ele. As espécies químicas que, de fato, participam do processo de óxido-redução são H2 e H+. Se a semicela H+/H2 atuar com ânodo, a semirreação será a de oxidação de H2 a H+ e, se atuar como cátodo, será a de redução de H+ a H2.
Ao usar a semicela H+/H2, a placa de platina serve como elemento metálico capaz de receber elétrons vindos do circuito externo ou enviar elétrons para ele. As espécies químicas que, de fato, participam do processo de óxido-redução são H2 e H+. Se a semicela H+/H2 atuar com ânodo, a semirreação será a de oxidação de H2 a H+ e, se atuar como cátodo, será a de redução de H+ a H2.
A diferença de potencial elétrico entre os pólos de uma cela galvânica, medida com voltímetro numa situação em que a cela não esteja fornecendo corrente elétrica para um circuito, é representado por ΔE.
Se essa diferença de potencial for medida nas condições-padrão (convencionadas como 1,0 mol/L e 100 kPa*) e em uma temperatura de interesse (geralmente 25°C), ela é denominada diferença de potencial-padrão e representada por ΔE°. Já sabemos que o potencial elétrico do cátodo é maior que o do ânodo. Assim, podemos dizer que o valor de AE° é dado por:

Como já foi dito, o voltímetro não mede valores de potencial, mas sim diferenças de potencial. Assim, não há um modo de medir isoladamente 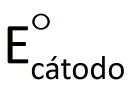 ou
ou 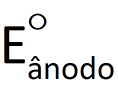 . Apenas medimos a diferença entre ambos (ΔE°).
. Apenas medimos a diferença entre ambos (ΔE°).
O valor de E° para o eletrodo-padrão de hidrogênio foi convencionado como sendo 0 V (zero volt), quer ele atue como ânodo, quer como cátodo.
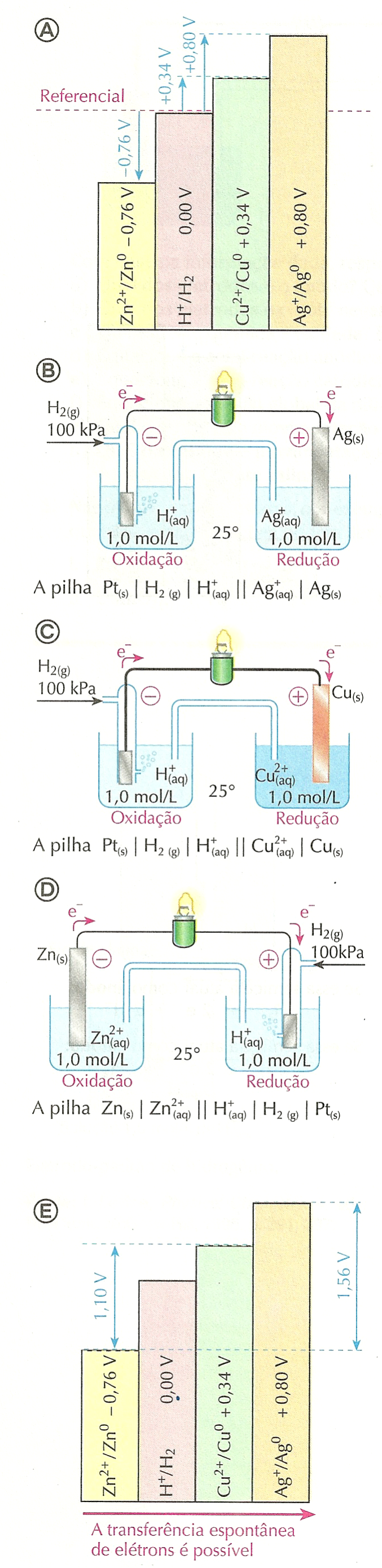
A partir dessa definição podemos, de acordo com os fatos experimentais, resumidos no esquema , afirmar que:
o potencial-padrão da semicela Ag+/ Ag0 é +0,80 V;
o potencial-padrão da semicela Cu2+/ Cu0 é +0,34 V;
o potencial-padrão da semicela Zn2+/ Zn0 é -0,76 V.
O potencial-padrão de uma semicela é o valor da diferença de potencial elétrico, nas condições-padrão (1,0 mol/L e 100 kPa) e numa temperatura de interesse (geralmente 25°C), entre o eletrodo dessa semicela e o eletrodo-padrão de hidrogênio.
Vimos, no início, que os elétrons se movimentam na parte metálica de um circuito elétrico de um ponto de menor potencial elétrico para um ponto de maior potencial elétrico.
O fato de o potencial-padrão da semicela Ag+/Ag0 ser +0,80 V indica que, na pilha formada por Ag+/Ag0 e H+/H2, o eletrodo de hidrogênio atua como pólo negativo e o de prata, como pólo positivo. Isso porque os elétrons se deslocarão, pelo fio, do eletrodo de hidrogênio (de menor potencial elétrico) para o de prata (de maior potencial). Teremos, para essa pilha, a situação ilustrada esquematicamente na figura (B), ao lado. Há oxidação do H2 e redução dos íons Ag+.
O fato de o potencial-padrão da semicela Cu2+/Cu0 ser +0,34 V indica que, na pilha formada por ela e pela semicela H+/H2, o eletrodo de hidrogênio (menor potencial elétrico) atua como pólo negativo e o de cobre (maior potencial elétrico), como pólo positivo. Assim, teremos a situação mostrada no esquema (C), com a oxidação do H2 e a redução dos íons Cu2+.
No caso da semicela Zn2+/Zn0, a situação se inverte, pois o seu potencial, -0,76 V, é inferior ao do eletrodo-padrão de hidrogênio. O eletrodo de zinco (menor potencial elétrico) funcionará como pólo negativo, emitindo elétrons pelo circuito metálico para o eletrodo de hidrogênio (maior potencial elétrico). A pilha funciona de acordo com o esquema (D), com oxidação do Zn0 e redução dos íons H+.
O esquema (E) resume essa discussão.
Quando uma pilha é usada para gerar corrente elétrica em um circuito, os elétrons se movimentam, na parte metálica do circuito, do eletrodo de menor potencial para o de maior potencial elétrico. O esquema (E) também nos permite fazer previsões.
Por exemplo, podemos prever que a diferença de potencial entre as semicelas Cu2+/ Cu0 e Zn2+/ Zn0, que tomam parte da pilha de Daniell, é de 1,10 V.
Ao comparar, no esquema (E), as semicelas Zn2+/Zn0 e Ag+/Ag0, percebemos que a diferença de potencial-padrão entre ambas é de 1,56 V, sendo que o potencial da semicela de prata é maior que o da semicela de zinco. Ambas semicelas formariam, portanto, uma pilha com diferença de potencial elétrico de 1,56 V, na qual o pólo negativo é o eletrodo de zinco e o pólo positivo é o eletrodo de prata. Essa previsão também é confirmada experimentalmente!
Podemos concluir que, quanto maior o potencial-padrão de uma semicela, maior é a tendência de ela receber elétrons e de nela acontecer redução.
Quanto maior o potencial-padrão de uma semicela (E°), maior a tendência de ela receber elétrons, ou seja, maior a tendência de nela ocorrer redução. Por isso, essa grandeza também é conhecida como potencial-padrão de redução e simbolizada por Eoredução.
A força eletromotriz de uma pilha é a diferença de potencial elétrico medida entre os seus terminais, quando ela não está sendo usada para gerar corrente. Quanto maior o valor dessa grandeza (representada por ΔE°), maior a capacidade de a pilha gerar corrente elétrica.
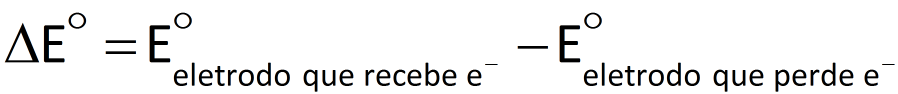
Por exemplo, no caso da pilha de Daniell, temos:
E° = E°(Cu2+/ Cu0) - E°(Zn2+/Zn0) = +0,34 V - (-0,74 V) = 1,10 V
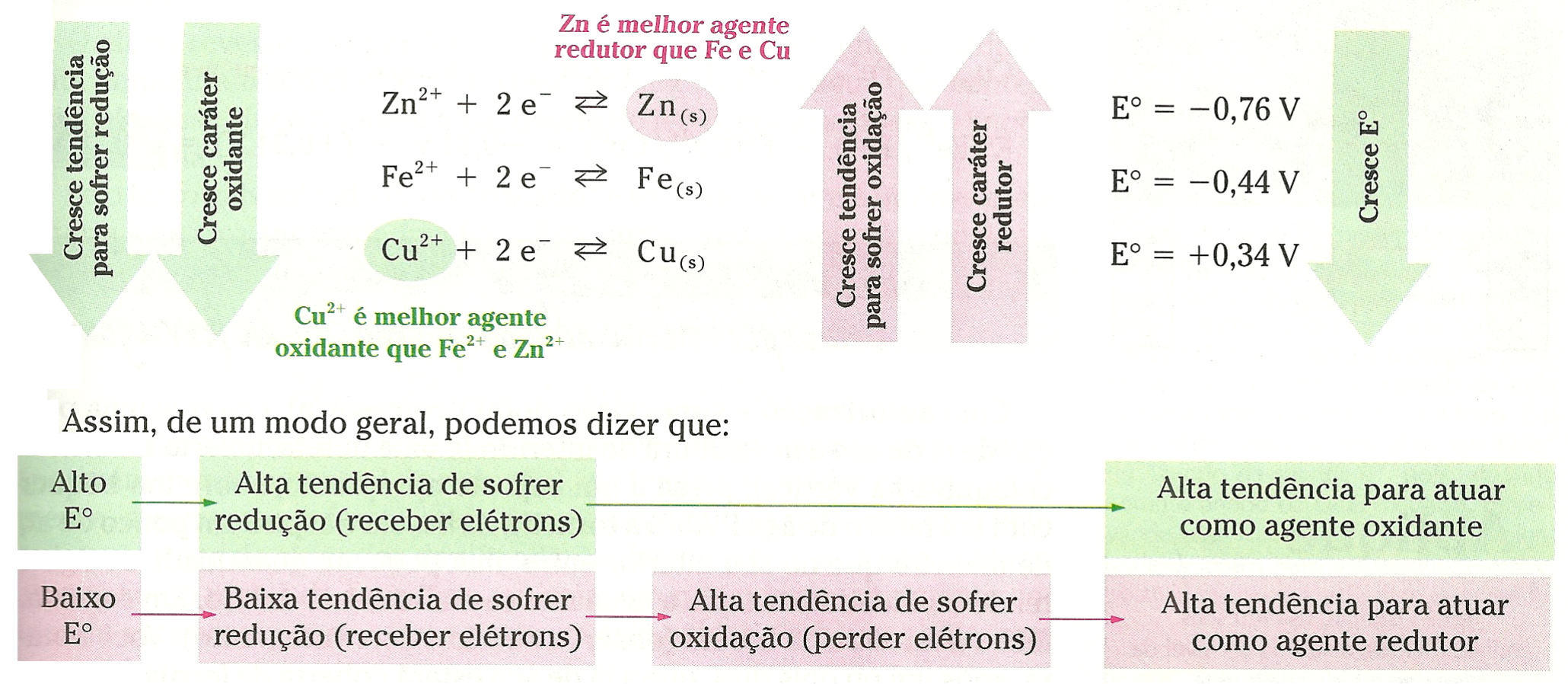
Numa reação de óxido-redução que ocorra espontaneamente, os elétrons são transferidos de uma espécie química com menor potencial de redução para outra com maior potencial de redução. Portanto, se calcu-larmos a diferença de potencial para esse processo, chegaremos a um valor positivo.
Reação de óxido-redução espontânea:
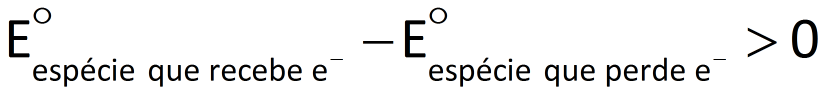
Reação de óxido-redução não-espontânea:
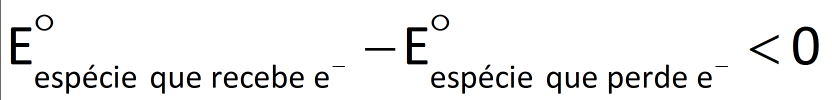
Veja os cálculos:

O ferro na presença de água isenta de ar (ausência de gás oxigênio) ou na presença de ar seco (ausência de umidade) praticamente não enferruja (ausência de corrosão). Contudo, o que ocorre normalmente é o ferro ficar exposto à água contendo oxigênio dissolvido, e é aí que está o problema.
As equações a seguir representam o que acontece na corrosão do ferro (ou do aço, uma liga de ferro com um pouco de carbono) na presença de água que contenha oxigênio dissolvido ou na presença de ar úmido.
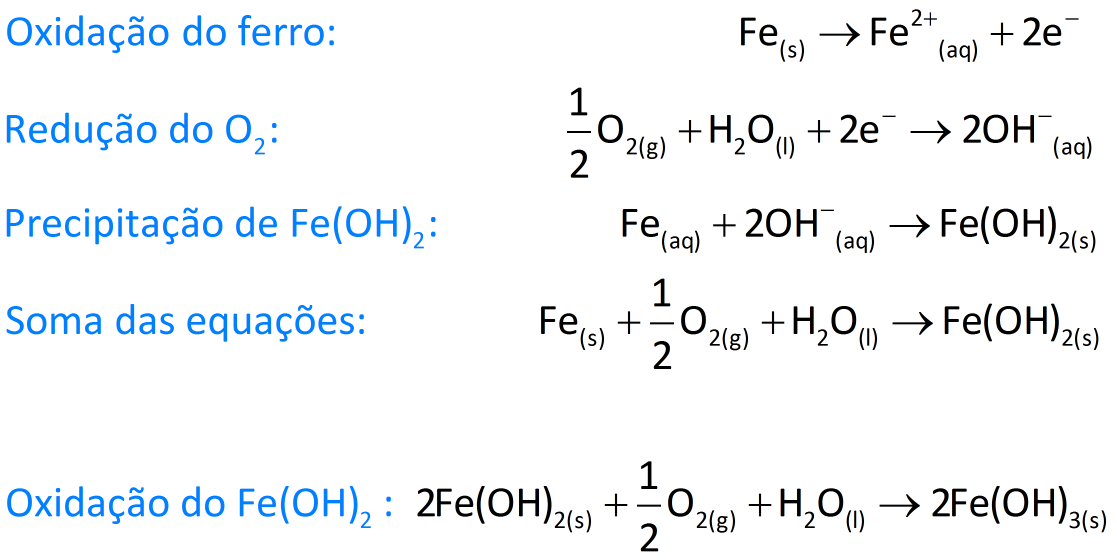
A ferrugem, que pode ser encarada como uma mistura de Fe(OH)2 e Fe(OH)3, ao ser formada na superfície do ferro ou do aço, solta-se em flocos, deixando o ferro novamente exposto e sujeito à oxidação.
Um procedimento possível para proteger o ferro da corrosão em ambientes nos quais esteja exposto à água e ao gás oxigênio é a galvanização. Galvanizar o ferro ou o aço consiste em revesti-los com zinco metálico (como se fosse uma fina película de tinta) para evitar sua corrosão. O zinco foi escolhido por ser um redutor mais forte que o ferro. Vejamos:
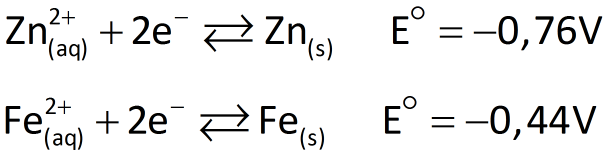
O zinco reveste a superfície do ferro como se fosse uma camada de tinta, impedindo seu contato com o ar úmido ou com a água que contém oxigênio. Esse zinco também atua, diante do ferro, como se fosse o ânodo de uma pilha.
Se o ferro galvanizado fosse "riscado" e exposto ao ar e à umidade, ele estaria sujeito a ser oxidado a Fe2+. Este seria imediatamente reduzido a Fe pelo zinco, impedindo o aparecimento da ferrugem.
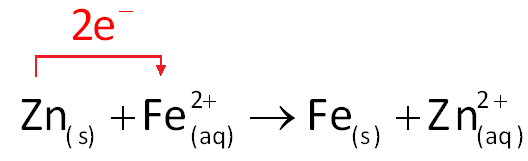
Porém, como o zinco tem mais facilidade para se oxidar que o ferro (pois tem menor potencial de redução), ele tende a se oxidar preferencialmente, mesmo que o ferro esteja exposto. Em outras palavras, se a película protetora de zinco for danificada e o ferro estiver exposto, o zinco atuará como metal de sacrifício, ou seja, um metal propositalmente colocado em contato com o ferro para que seja oxidado em lugar dele, preservando-o.
d) O cobre é o agente oxidante, pois ele causou a oxidação do zinco.
e) Correta.
14) A 15) E 16) D 17) C 18) E 19) A 20) E 21) D 22) D 23) A 24) A 25) D
26) B 27) 01 + 08 + 16 = 25 28) A 29) E 30) 02 + 04 + 08 + 16 = 30 31) A 32) E
33) B 34) D 35) E 36) A 37) B 38) C 39) C 40) A 41) B 42) B 43) C 44) A
45) B 46) C 47) B 48) B 49) D 50) D 51) D 52) E 53) A 54) C 55) E 56) C
57) C 58) D 59) A 60) O espessamento da barra de chumbo, implica em ganho de massa e portanto ganho de elétrons ,ou seja redução; portanto o desgaste da barra de zinco implica em perda de elétrons , ou seja , em oxidação.
Desgaste da barra de zinco:
Zn(s)  Zn 2+ (aq) + 2e- (oxidação)
Zn 2+ (aq) + 2e- (oxidação)
Espessamento da barra de chumbo:
Pb2+(aq) + 2e-  Pb(s) (redução)
Pb(s) (redução)
Os elétrons fluem do eletrodo de zinco para o de chumbo.
Eletroquímica e pilhas - resumo
Reações químicas podem produzir correntes elétricas e correntes elétricas podem produzir reações químicas
de óxido-redução. Temos então:
A. Pilhas, baterias e acumuladores - são dispositivos que produzem corrente elétrica por intermédio de uma reação espontânea de óxido-redução.
B. Eletrólise - é o processo de obtenção de uma reação de óxido-redução por meio de uma corrente elétrica.
A. Pilhas - existem vários tipos de pilhas e baterias, mas por motivos didáticos adota-se, normalmente, o esquema exemplo abaixo, chamada de pilha de Daniell:
No eletrodo de cobre (Cu) (catodo):

No catodo ocorre a redução.
No eletrodo de zinco (Zn) (anodo):
No eletrodo de zinco (Zn) (anodo):
No anodo ocorre a oxidação.
Por convenção internacional a reação de uma pilha é:
1. Potenciais de oxidação e de redução
2. Determinação do potencial de redução
Para a determinação do potencial de redução utiliza-se um eletrodo de gás hidrogênio, considerado como de potencial de redução zero.
3. Maior potencial de redução
Em uma pilha, o elemento que possui maior potencial de redução é que sofre a redução, enquanto aquele que tem maior potencial de oxidação sofre a oxidação.
A tabela abaixo mostra os potenciais de redução de alguns elementos (em solução aquosa a 25°C):
Determinação da fem (E) (força eletromotriz) de uma pilha - a fem de uma pilha pode ser determinado pela diferença entre os potenciais de redução dos eletrodos da pilha:
Por exemplo, em uma pilha de alumínio e cobre:
Eletrólise - é uma reação química, onde existam íons, produzida por uma corrente elétrica. A eletrólise pode ser ígnea ou em meio aquoso.
Eletrólise ígnea - é feite na ausência de água, com a substância pura no estado líquido (fundida). Por exemplo, a eletrólise do cloreto de sódio (NaCl) que produz sódio metálico (Na) e cloro (Cl2) na forma de gás, utilizando eletrodos de platina:
Sendo as reações intermediárias:
Com duas semi-reações:
Somando-se (I) e (II):
Eletrólise em meio aquoso - nesse tipo de reação não se levam em conta somente os íons dos solutos, mas também os da água que se ioniza. Utilizando-se o exemplo do cloreto de sódio (NaCl) acima, agora em meio aquoso, temos duas eletrólises:
e:
Somando-se as quatro semi-reações:
Quantificação de carga na eletrólise - para o cálculo da corrente elétrica necessária para a eletrólise temos, por exemplo, para a prata:Quantificação de carga na eletrólise - para o cálculo da corrente elétrica necessária para a eletrólise temos, por exemplo, para a prata:
Como cada elétron possui uma carga elementar de:
A carga total será:
O papel da ponte salina

Nomenclatura dos eletrodos em uma cela galvânica

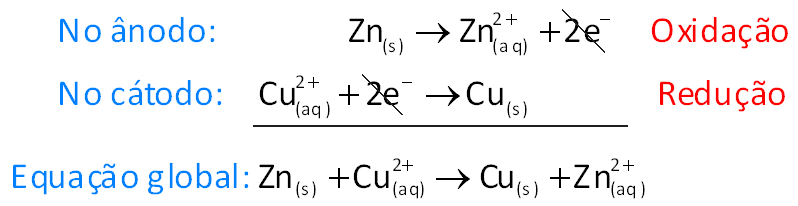
Representação esquemática para uma cela galvânica

Potencial-Padrão De Semicela
A semicela adotada como referencial em Eletroquímica
 Ao usar a semicela H+/H2, a placa de platina serve como elemento metálico capaz de receber elétrons vindos do circuito externo ou enviar elétrons para ele. As espécies químicas que, de fato, participam do processo de óxido-redução são H2 e H+. Se a semicela H+/H2 atuar com ânodo, a semirreação será a de oxidação de H2 a H+ e, se atuar como cátodo, será a de redução de H+ a H2.
Ao usar a semicela H+/H2, a placa de platina serve como elemento metálico capaz de receber elétrons vindos do circuito externo ou enviar elétrons para ele. As espécies químicas que, de fato, participam do processo de óxido-redução são H2 e H+. Se a semicela H+/H2 atuar com ânodo, a semirreação será a de oxidação de H2 a H+ e, se atuar como cátodo, será a de redução de H+ a H2.O conceito de potencial-padrão de semicela


em que 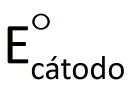 e
e 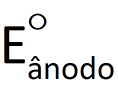 representam, respectivamente, os potenciais elétricos do cátodo e do ânodo.
representam, respectivamente, os potenciais elétricos do cátodo e do ânodo.
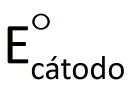 e
e 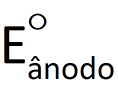 representam, respectivamente, os potenciais elétricos do cátodo e do ânodo.
representam, respectivamente, os potenciais elétricos do cátodo e do ânodo.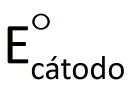 ou
ou 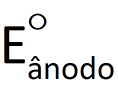 . Apenas medimos a diferença entre ambos (ΔE°).
. Apenas medimos a diferença entre ambos (ΔE°).Interpretação dos potenciais-padrão de semicela
Aplicações Da Tabela De Potenciais-Padrão
Previsão da força eletromotriz de uma pilha
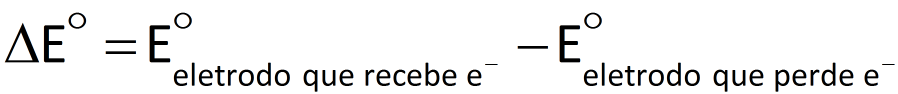
Comparação da força de oxidantes e redutores

Espontaneidade de reações de óxido-redução
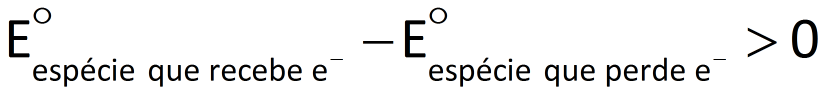
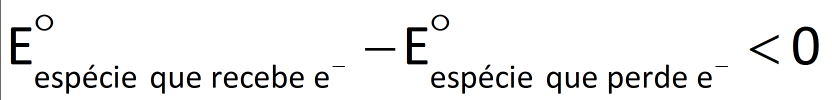

A proteção de uma superfície metálica

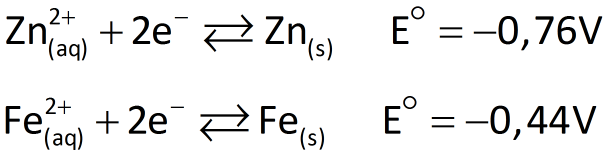
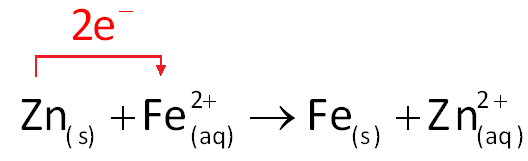

Nenhum comentário:
Postar um comentário