A Termoquímica estuda o calor da reação provocada pela troca de energia do meio externo com os reagentes. Toda reação química absorve ou gera calor, ou seja, há sempre uma troca de energia. A emissão ou absorção de luz, de calor, de eletricidade são manifestações dessa energia que podem até provocar mudanças de estado físico nos componentes das reações.
Equação termoquímica e gráficos de entalpia
Equação termoquímica é uma reação química que apresenta:
1) Quantidade de reagentes e produtos (reação devidamente balanceada).
2) Temperatura e pressão.
3) Estrutura cristalina ou alotrópica (se for o caso).
4) Estado físico de reagentes e produtos.
5) O calor da reação (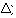 H).
H).
Ex: 1 C(gr) + 1 O2 (g) 1 CO2 (g)
1 CO2 (g)
Outro exemplo de equações termoquímicas:
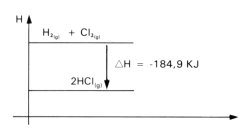
H2(g) + Cl2(g) => 2 HCl(g) + 184,9 kJ (25ºC, 1 atm)
Segundo a equação, 1 mol de hidrogênio gasoso reage com 1 mol de cloro gasoso formando 2 mols de cloreto de hidrogénio gasoso, liberando 184,9 kJ de calor. Tal reação foi realizada à temperatura de 25ºC e à pressão de 1 atm.
Podemos também escrever essa equação termoquímica utilizando a notação ?H. Neste caso temos:
H2(g) + Cl2(g) => 2 HCl(g), 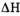 = -184,9 kJ (25ºC, 1 atm)
= -184,9 kJ (25ºC, 1 atm)
O valor numérico de 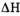 é precedido do sinal negativo pois a reação é exotérmica.
é precedido do sinal negativo pois a reação é exotérmica.
Graficamente, a variação de entalpia que acompanha a reação é representada por:
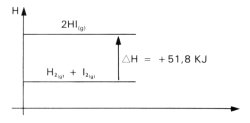
- H2(g) + I2(g) + 51,8 kJ => 2 HI (g) (25ºC, 1 atm)
Segundo a equação, quando, a 25ºC e 1 atm, 1 mol de hidrogênio gasoso reage com 1 mol de iodo gasoso, formando 2 mols de iodeto de hidrogênio gasoso, são absorvidos 51,8 kJ de calor.
A equação também pode ser escrita utilizando a notação AH:
H2(g) + I2(g) => 2 HI (g) AH = + 51,8 kJ (25ºC, 1 atm)
O valor numérico de AH é positivo, pois a reação é endotérmica.
Graficamente a variação de entalpia dessa reação pode ser representada por:
Observações: 1. Estado padrão na termoquímica é caracterizado por:
– Temperatura de 25°C
– Pressão de 1atm.
– Estrutura cristalina ou alotrópica mais estável (se for o caso).
– Estado físico usual da substância.
2. Por convenção, substância simples ou elemento químico no estado padrão possui entalpia sempre zero.
– Calor ou entalpia padrão de formação (DH)0f : endotérmico ou exotérmico.
– Calor ou entalpia de combustão (exotérmico).
– Calor ou entalpia ou energia de ligação (endotérmico).
– Calor ou entalpia de neutralização (exotérmico).
– Lei de Hess.
PRINCÍPIO DE THOMPSEN E BERTHELOT
Há um princípio fundamental da Termoquímica, determinado em 1867 pelos cientistas que lhe deram seus nomes, que afirma: "Dentre um conjunto de reações químicas possíveis, ocorrerá primeiro, espontaneamente, aquela que for mais exotérmica." A reação exotérmica é aquela que libera maior quantidade de energia na forma de calor.
Isto significa que os produtos formados nesse tipo de reação são menos energéticos, portanto, mais estáveis.
Espontaneamente, as substâncias só irão reagir em busca de maior estabilidade e, desse modo, em busca de liberar a maior quantidade possível de energia.
Sendo que podemos dizer:
mais estabilidade = menos energia = menor D H = reação mais espontânea
Há um princípio fundamental da Termoquímica, determinado em 1867 pelos cientistas que lhe deram seus nomes, que afirma: "Dentre um conjunto de reações químicas possíveis, ocorrerá primeiro, espontaneamente, aquela que for mais exotérmica." A reação exotérmica é aquela que libera maior quantidade de energia na forma de calor.
Isto significa que os produtos formados nesse tipo de reação são menos energéticos, portanto, mais estáveis.
Espontaneamente, as substâncias só irão reagir em busca de maior estabilidade e, desse modo, em busca de liberar a maior quantidade possível de energia.
Sendo que podemos dizer:
mais estabilidade = menos energia = menor D H = reação mais espontânea
Entalpia
Entalpia é a quantidade de energia contida em uma determinada substância que sofre reação, ela calcula o calor de um sistema, é a forma mais usada de expressar o conteúdo calorífico de um componente em uma reação química. A variação da Entalpia está na diferença entre a entalpia dos produtos e a dos reagentes (H1 → H2), sendo assim, o calor de uma reação corresponde ao calor liberado ou absorvido em uma reação, e é simbolizado por ∆ H.
Não há como determinar a quantidade de energia em uma substância, mas podemos conhecer e medir sua variação. Para isso utiliza-se a fórmula:
Δ H = H final – H inicial
Em reações exotérmicas a entalpia final é menor do que a entalpia inicial, de modo que ∆H tem valor negativo (∆H < 0). Neste tipo de reação ocorre a liberação de energia. Exemplo: queima de alimentos pelo organismo, reações de combustão.
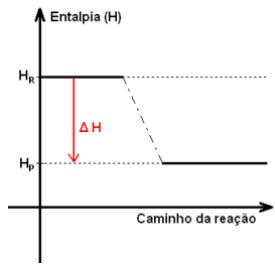
Usando valores imaginários de entalpia, o leitor poderá entender mais facilmente o sinal de ∆H.
∆H = HP – HR = 32 – 100 = -68
∆H = HP – HR = 32 – 100 = -68
H2(g) + 1/2O2(g) → H2O(l) ∆H = -68 kcal
Classicamente, o calor de reação seria um “produto”:
H2(g) + 1/2O2(g) → H2O(l) + 68 kcal
H2(g) + 1/2O2(g) → H2O(l) + 68 kcal
Em reações endotérmicas, a entalpia final é maior que a entalpia inicial, de modo que o ∆H tem um valor positivo (∆H > 0). Neste tipo de reação ocorre a absorção de energia.
Exemplo: Quando a luz solar incide em uma molécula de clorofila das plantas, ocorre uma reação endotérmica, a planta absorve parte da energia luminosa permitindo a reação do gás carbônico com água, que produz carboidratos e libera oxigênio. A absorção da energia em forma de luz e sua transformação em energia química permitem o crescimento das plantas, seu florescimento e a produção de frutos.
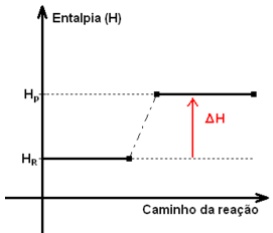
Usando valores imaginários, teríamos:
∆H = HP – HR = -62,4 – 50 = + 12,4
∆H = HP – HR = -62,4 – 50 = + 12,4
H2(g) + I2(s) → 2HI(g) ∆H = + 12,4 kcal
Classicamente, o calor de reação seria um “reagente”.
H2(g) + I2(s) + 12,4 kcal → 2HI(g)
H2(g) + I2(s) + 12,4 kcal → 2HI(g)
ou
H2(g) + I2(s) → 2HI(g) – 12,4 kcal
Tipos de Entalpia
Entalpia de combustão
Entalpia de combustão corresponde à energia liberada, na forma de calor, em uma reação de combustão de 1 mol de substância.
Visto que as reações de combustão são sempre exotérmicas – como a queima da madeira ou da gasolina –, o valor da entalpia de combustão será negativo, menor que zero (∆H < 0), pois, em razão do calor ser liberado, a energia dos produtos será menor que a dos reagentes.
As reações que são classificadas como de combustão são aquelas em que uma substância, que é denominada combustível, reage com o gás oxigênio (comburente). Existem dois tipos de reações de combustão, a completa e a incompleta. Quando a reação de combustão é completa, isto é, quando libera como produtos somente dióxido de carbono (CO2 – também comumente conhecido por gás carbônico) e água (H2O), dizemos que está na condição padrão. Por isso, a entalpia ou, mais corretamente, variação da entalpia, é denominada entalpia-padrão de combustão
(∆H0combustão) ou calor-padrão de combustão.
Esse tipo de reação se dá com compostos que possuem apenas carbono, hidrogênio e oxigênio como a grafite*, os hidrocarbonetos, os álcoois e os carboidratos. Veja alguns exemplos abaixo:
Visto que as reações de combustão são sempre exotérmicas – como a queima da madeira ou da gasolina –, o valor da entalpia de combustão será negativo, menor que zero (∆H < 0), pois, em razão do calor ser liberado, a energia dos produtos será menor que a dos reagentes.
As reações que são classificadas como de combustão são aquelas em que uma substância, que é denominada combustível, reage com o gás oxigênio (comburente). Existem dois tipos de reações de combustão, a completa e a incompleta. Quando a reação de combustão é completa, isto é, quando libera como produtos somente dióxido de carbono (CO2 – também comumente conhecido por gás carbônico) e água (H2O), dizemos que está na condição padrão. Por isso, a entalpia ou, mais corretamente, variação da entalpia, é denominada entalpia-padrão de combustão
(∆H0combustão) ou calor-padrão de combustão.
Esse tipo de reação se dá com compostos que possuem apenas carbono, hidrogênio e oxigênio como a grafite*, os hidrocarbonetos, os álcoois e os carboidratos. Veja alguns exemplos abaixo:
Combustão completa do metano, CH4(g)
CH4(g) + ½ O2 → 1 CO2(g) + 2 H2O(ℓ) ∆H0combustão = -890,4 kJ/mol
Combustão completa do etanol, C2H6O(l)
Combustão completa do etanol, C2H6O(l)
1 C2H6O(ℓ)+ 3O2 → 2 CO2(g) + 3 H2O(ℓ) ∆H0combustão = -1366,1 kJ/mol
Combustão completa do butano, C4H10(g)
Combustão completa do butano, C4H10(g)
2 C4H10(g)+ 13O2 → 8 CO2(g) + 10 H2O(ℓ) ∆H0combustão = -2878,6 kJ/mol

Observe que em todos os casos os valores de ∆H0combustão são negativos (∆H0combustão = < 0),isso ocorre porque as reações de combustão liberam energia (são exotérmicas), assim, o valor da entalpia final será menor que a inicial.
Entalpia de neutralização
Entalpia de combustão | |||
Substância
|
Fórmula
|
kcal/mol
|
kJ/mol
|
Acetileno
|
C2H2(g)
|
-310,6
|
-1299,6
|
Ácido etanóico
|
H3C-COOH(L)
|
-208,5
|
-872,4
|
Benzeno
|
C6H6(L)
|
-781,0
|
-3267,7
|
Butano
|
C4H10(g)
|
-688,0
|
-2878,6
|
Etano
|
C2H6(g)
|
-372,8
|
-1599,8
|
Etanol
|
H3C-CH2-OH(L)
|
-326,5
|
-1366,1
|
Eteno
|
C2H4(g)
|
-337,2
|
-1410,8
|
Glicose
|
C6H12O6 (S)
|
-673,0
|
-2815,8
|
Grafita
|
C(s)
|
-94,1
|
-393,3
|
Hidrogênio
|
H2(g)
|
-68,3
|
-285,8
|
Metano
|
CH4(g)
|
-212,8
|
-890,4
|
Metanol
|
H3C-OH(L)
|
-173,6
|
-726,3
|
Monóxido de carbono
|
CO(g)
|
-67,6
|
-282,8
|
Propano
|
C3H8(g)
|
-530,6
|
-2220,0
|
Sacarose
|
C12H22O11 (S)
|
-1348,9
|
-5643,8
|
Entalpia de neutralização
Uma reação de neutralização ocorre quando um ácido reage com uma base formando água e sal. O ácido fornece os íons H+ e a base fornece os íons OH- para a formação da água (H2O):
1 H+(aq) + 1 OH-(aq) → H2O(ℓ)
Esse tipo de reação é denominada de “neutralização” porque o pH do meio é neutralizado; o pH da água é 7,0 (neutro).
Para que essas reações ocorram é necessário que se libere certa quantidade de calor, pois apenas uma parte da energia dos íons é usada para formar as ligações que resultam nas moléculas de água, enquanto que o restante da energia é liberado para o meio. Essa energia liberada é denominada Entalpia de Neutralização (∆Hneutralização).

Visto que libera calor, corresponde a reações exotérmicas, em que a entalpia (energia global do sistema) sempre será negativa, menor que zero.
No caso da reação entre ácidos fortes e bases fortes o valor da entalpia de neutralização sempre será igual a – 13,8 kcal/mol ou – 57,7 kJ/mol. Isso acontece porque as bases e os ácidos fortes ficam dissociados completamente em solução e, com isso, a única reação responsável pela manifestação do calor será a da formação da água, como mostrado nos três exemplos abaixo:
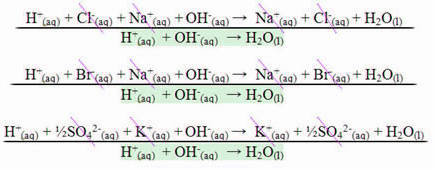
No caso de reações de neutralização que envolvam ácidos ou bases fracas, o valor da entalpia de neutralização será menor que – 57,7 kJ/mol.
Assim, em todos esses casos, o diagrama ou gráfico que representa a entalpia de neutralização será o mesmo, mostrado a seguir:
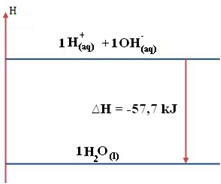
No entanto, se a reação de neutralização ocorre com a presença de uma base ou de um ácido fracos, o valor do calor liberado será menor do que o ∆Hneutralização = -57,7 kJ. Isso ocorre porque parte da energia liberada é usada também para ionizar mais ácido (se o ácido for fraco), ou para dissociar mais base (se a base for fraca). Dessa forma, ocorrem duas reações, como no caso abaixo em que a base é forte, mas o ácido é fraco:

Entalpia-padrão
A entalpia-padrão é a variação de entalpia da formação de 1 mol de um produto por meio de seus elementos constituintes (substâncias simples), todos em seus estados-padrão.
Existem vários fatores que podem alterar a variação da entalpia de um processo, tais como a temperatura, a pressão, o estado físico, o número de mol e a variedade alotrópica do composto. Por exemplo, abaixo temos três reações de formação do dióxido de carbono, nas mesmas condições de temperatura e pressão. Porém, em cada um foi utilizada uma quantidade de matéria para os reagentes. Em razão disso, a variação da entalpia de cada reação deu um valor diferente:
C(grafite) + O2(g) → CO2(g) ∆H = -393 kJ (25ºC, 1 atm)
½ C(grafite) + ½ O2(g) → ½ CO2(g) ∆H = -196,5 kJ (25ºC, 1 atm)
2 C(grafite) + 2 O2(g) → 2 CO2(g) ∆H = -786 kJ (25ºC, 1 atm)
No entanto, quando o valor da variação da entalpia é medido para 1 mol de substância em condições padrão (quando a substância está na sua forma alotrópica mais estável, a temperatura de 25ºC e sob pressão de 1 atm), ele é denominado entalpia-padrão.
Se todos os reagentes e produtos estiverem no estado padrão, a variação da entalpia será indicada pelo seguinte símbolo ∆H0, lembrando que a variação da entalpia é dada por: ∆H = HPRODUTOS – HREAGENTES.
A entalpia-padrão é importante porque ela serve como padrão de referência. Por exemplo, adotou-se que para todas as substâncias simples nas condições-padrão o valor da entalpia é igual a zero.
Por exemplo, o gás hidrogênio (H2), a 25 ºC, sob 1 atm, no estado gasoso H0= 0. Se ele estiver em qualquer outra condição, a sua entalpia será H0≠ 0.
Quando a substância simples apresenta variedades alotrópicas, o valor H0= 0 será atribuído à variedade alotrópica mais comum. Por exemplo, o oxigênio possui duas formas alotrópicas, a de gás oxigênio (O2) e a de ozônio (O3), o gás oxigênio é o mais comum, portanto, ele possui H0= 0 e o ozônio apresenta H0≠ 0.
Veja mais três exemplos:
- Carbono:
O Cgrafite possui H0= 0 e o Cdiamante apresenta H0≠ 0. - Fósforo:
O fósforo branco possui H0= 0 e o fósforo vermelho apresenta H0≠ 0. - Enxofre:
O enxofre rômbico possui H0= 0 e o enxofre monoclínico apresenta H0≠ 0.

Sabendo disso, é possível determinar a entalpia de substâncias que não sejam simples, mas que sejam formadas por substâncias simples. Por exemplo, considere a seguinte reação:
Sn(s) + O2(g) → SnO2(s) ∆H = -580 kJ (25ºC, 1 atm)
Podemos calcular a entalpia de SnO2(s) (HSnO2) nessa reação, pois sabemos que as entalpias dos dois reagentes é igual a zero, pois são substâncias simples:
∆H = HPRODUTOS – HREAGENTES
∆H = HSnO2 – (HSn + HO2)
-580 kJ = HSnO2 – 0
HSnO2= - 580 kJ
∆H = HSnO2 – (HSn + HO2)
-580 kJ = HSnO2 – 0
HSnO2= - 580 kJ
O valor deu negativo porque a sua entalpia é menor que a entalpia dos reagentes e não porque o seu conteúdo de energia é negativo, pois isso não seria possível.
Entalpia de formação
O calor de formação , ou entalpia padrão de formação (ΔfH0) de um composto químico é a variação da entalpia da reação de formação deste composto a partir de suas espécies elementares que o compõem, ou seja, é a energia liberada ou absorvida pela reação de formação de compostos. A reação de formação de composto consiste na formação do composto em questão a partir dos seus elementos na sua forma mais estável em condições PTN (no Brasil CNTP).
A unidade da variação de entalpia no SI é kJ/mol.
Quando a entalpia de formação é omitida na equação química da reação, significa que foi medida na temperatura de 298 K e pressão de 1 atm.
A formula de como calcular o Entalpia de Formação:ΔH= Hprodutos - HReagentes.
Exemplo: A entalpia de formação da água, formada por hidrogênio e oxigênio, é equivalente a entalpia da reação de hidrogênio diatômico com oxigênio diatômico, ambos gasosos:
H2 (g) + ½ O2 (g) ⇒ H2O(l) ΔfH0 = - 285,5 kJ/mol
significa que a formação de 1 mol de água (6,02. 1023 moléculas = 18 gramas), no estado líquido, a partir das espécies elementares hidrogênio e oxigênio à temperatura de 298 K e 1 atm libera 285,5 kJ/mol de energia calorífica.
Outro exemplo:
NH4Cl é formado pela seguinte reação:
NH3 + HCl → NH4Cl ΔH = -176 kJ/mol
Observe que nenhum dos reagentes é uma substância simples, portanto, não podemos atribuir a eles a entalpia igual a zero. Precisamos saber as entalpias de formação de cada um dos reagentes, pois esses sim são formados por reações entre substâncias simples:
NH3 : ΔH = -46 kJ/mol
HCl : ΔH = -92,4 kJ/mol
HCl : ΔH = -92,4 kJ/mol
Somando essas duas entalpias, obtemos o valor da entalpia dos reagentes e podemos descobrir a entalpia do NH4Cl:
HR = HNH3 + HHCl
HR = (-46 + (-92,4) kJ/mol)
HR = -138,4 kJ/mol
HR = (-46 + (-92,4) kJ/mol)
HR = -138,4 kJ/mol
Substituindo na fórmula:
ΔH = HProdutos – HReagentes
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 kJ/mol
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 kJ/mol
Nesse caso, somamos diretamente os valores das entalpias de formação dos reagentes porque a proporção da reação era de apenas 1 mol. No entanto, se em outras reações a quantidade de mols for diferente, será necessário primeiro multiplicar a entalpia de formação do reagente pelo número de mols.
A entalpia de formação das espécies químicas elementares, nas mesmas condições, é arbitrada como sendo zero. Exemplos:
Hidrogênio: H2 (g)
Hélio: He (g)
Carbono: C (cr) (grafite)
Nitrogênio: N2 (g)
Oxigénio: O2 (g)
Flúor: F2 (g)
Cloro: Cl2 (g)
Bromo: Br2 (l)
Iodo: I2 (s)
Fósforo: P (vermelho)
Enxofre: S (rômbico)
Lei de Hess

A lei de Hess foi criada pelo químico suíço Germain H. Hess (1802-1850), que é considerado um dos fundadores da Termoquímica. Sua lei dizia o seguinte:

Constitui uma "ferramenta" poderosa para o cálculo da variação de entalpia de reações que não podem ser determinadas experimentalmente.
O processo para a resolução consiste em trabalhar convenientemente com as equações fornecidas de modo que, de sua soma algébrica, resulta na equação principal, possibilitando o cálculo do  .
.
De acordo com o Princípio da Conservação da Energia, esta não pode ser criada, nem destruída, apenas transformada.
Suponha as seguintes transformações:

A transformação do reagente A em produto B pode ocorrer por dois caminhos:
- direto, com variação de entalpia
 1,
1, - em etapas, do reagente A para o intermediário C, com variação de entalpia
 2, e daí para o produto B, com calor de reação
2, e daí para o produto B, com calor de reação  3.
3.
Como a energia não pode ser criada nem destruída, então:  1 =
1 =  2 +
2 +  3.
3.
Caso esta igualdade não se verifique, teríamos perdido ou ganho energia, contrariando o Princípio da Conservação.
Em decorrência do Princípio da Conservação de Energia, a Lei de Hess diz que:
"A variação de entalpia de uma reação química depende apenas dos estados inicial e final do sistema, não importando etapas intermediárias pelas quais a transformação química passou".
Em outras palavras, se uma transformação química ocorre em várias etapas, o  da reação será igual à soma das variações de entalpia das diversas etapas.
da reação será igual à soma das variações de entalpia das diversas etapas.
Como conseqüência podemos somar duas ou mais equações termoquímicas e o  da equação resultante será igual à soma dos
da equação resultante será igual à soma dos  das equações adicionadas.
das equações adicionadas.
A Lei de Hess constitui uma "ferramenta" poderosa para o cálculo da variação de entalpia de reações que não podem ser determinadas experimentalmente.
O processo para a resolução consiste em trabalhar convenientemente com as equações fornecidas de modo que, de sua soma algébrica, resulta na equação principal, possibilitando o cálculo do  .
.
Além disso, devemos lembrar que na Lei de Hess:
- invertendo uma equação, o
 muda de sinal,
muda de sinal, - multiplicando os coeficientes de uma equação por um número, o
 também fica multiplicado por esse número.
também fica multiplicado por esse número.
Exemplo: O calor de formação do metano, CH4, não pode ser determinado por medidas calorimétricas pois a reação é lenta e apresenta reações secundárias.
A partir das seguintes equações
I. C(grafite) + O2(g) ⇔ CO2(g) = - 94,05 kcal
= - 94,05 kcal
I. C(grafite) + O2(g) ⇔ CO2(g)
II. H2(g) + ½ O2(g) ⇔H2O(l)  = - 68,32 kcal
= - 68,32 kcal
III. CH4(g) + 2 O2(g) ⇔ CO2(g) + 2 H2O(l)  = - 212,87 kcal
= - 212,87 kcal
pode-se determinar a variação da entalpia da reação de formação do metano:
C(grafite) + 2 H2(g) ⇔CH4(g)  = ?
= ?
As seguintes operações devem ser feitas:
- manter a equação I
- multiplicar a equação II por 2
- inverter a equação III
Assim,
C(grafite) + O2(g) ⇔ CO2(g)  = - 94,05 kcal
= - 94,05 kcal
H2(g) + ½ O2(g) ⇔ H2O(l)  = 2.(- 68,32) kcal
= 2.(- 68,32) kcal
CO2(g) + 2 H2O(l) ⇔CH4(g) + 2 O2(g)  = + 212,87 kcal
= + 212,87 kcal
__________________________________________________
C(grafite) + 2 H2(g) ⇔ CH4(g)  = - 17,82 kcal
= - 17,82 kcal
H20(l) → H20(g) ∆H = + 44 KJ
Exemplo 2
Repare que nesta equação a passagem de 1 mol de H20(l) para o estado gasoso foi feita numa única etapa, veja abaixo como obter o mesmo produto em duas etapas:
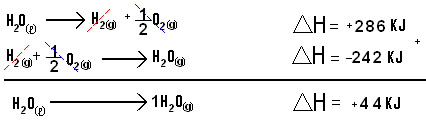
Calcule a variação de entalpia da seguinte reação pela Lei de Hess:
Dados:
Resolução:
Deve-se escrever todas as equações intermediárias (dados) de acordo com a reação global. Na primeira equação, o que há em comum é o C(grafite). Então ele deve ser escrito da mesma forma (como reagente e 1mol).
A segunda equação tem em comum com a reação global o H2(g). Nos dados, esta esécie química não está exatamente igual como na global. Deve-se multiplicar toda a equação por 2, inclusive a ΔH2
A terceira equação tem em comum com a reação global o CH4(g). deve-se inverter a posição desta equação e portanto trocar o sinal da ΔH3
A segunda equação tem em comum com a reação global o H2(g). Nos dados, esta esécie química não está exatamente igual como na global. Deve-se multiplicar toda a equação por 2, inclusive a ΔH2
A terceira equação tem em comum com a reação global o CH4(g). deve-se inverter a posição desta equação e portanto trocar o sinal da ΔH3
Veja como deve ser feito:
Energia de ligação
É a energia fornecida para romper 1 mol de ligações entre dois átomos e um sistema gasoso, a 25ºC e 1 atm.
A energia de ligação pode ser determinada experimentalmente. Na tabela tabela abaixo estão relacionadas as energias de algumas ligações.
| Ligação | Energia de ligação kcal/mol de ligações |
| H - H | 104,2 |
| Cl - Cl | 57,8 |
| H - Cl | 103,0 |
| O = O | 118,3 |
| Br - Br | 46,1 |
| H - Br | 87,5 |
| C - C | 83,1 |
| C - H | 99,5 |
| C - Cl | 78,5 |
Observe que os valores tabelados são todos positivos, isto porque o rompimento de ligações é um processo que consome energia, ou seja, é um processo endodérmico. A formação de ligações, ao contrário, é um processo que libera energia, processo exotérmico.
Para se determinar o 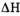 de uma reação a partir dos valores devemos considerar:
de uma reação a partir dos valores devemos considerar:
- que todas as ligações dos reagentes são rompidas e determinar a quantidade de energia consumida nesse processo;
- que as ligações existentes nos produtos foram todas formadas a partir de átomos isolados e determinar a quantidade de energia liberada nesse processo.
O 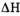 será correspondente à soma algébrica das energias envolvidas nos dois processos, o de ruptura e o de formação de ligações. É importante salientar que este método fornece valores aproximados de
será correspondente à soma algébrica das energias envolvidas nos dois processos, o de ruptura e o de formação de ligações. É importante salientar que este método fornece valores aproximados de 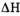 . Ele é muito útil na previsão da ordem de grandeza da variação de entalpia de uma reação.
. Ele é muito útil na previsão da ordem de grandeza da variação de entalpia de uma reação.
Entropia
Para medir o grau de desordem de um sistema, foi definida a grandeza termodinâmica entropia, representada pela letra S. Quanto maior a desordem de um sistema, maior a sua entropia.
O mínimo de entropia possível corresponde à situação em que átomos de uma substância estariam perfeitamente ordenados em uma estrutura cristalina perfeita. Essa situação deve ocorrer, teoricamente, a 0 K (zero absoluto). Em outras temperaturas, a entropia de uma substância deve ser diferente de zero. Quanto maior a temperatura de uma substância, maior o movimento das suas partículas, mais desorganizada ela está e, portanto, maior a sua entropia.
A entropia (cal/K.mol) a 25 °C para uma mesma substância, a entropia no estado gasoso é maior que aquela no estado líquido, que, por sua vez, é maior que a do estado sólido.
A variação de entropia em uma transformação depende apenas dos estados inicial e final do sistema, independentemente de como os reagentes se transformam nos produtos, isto é, do mecanismo da reação.
Por definição, a variação da entropia de uma transformação é igual à diferença entre a entropia dos produtos e dos reagentes:
∆S = Sprodutos – Sreagentes
Assim:
se ∆S > 0, então Sprodutos > Sreagentes; a transformação ocorre com aumento da desordem do sistema e tende a ser espontânea;
se ∆S < 0, então Sprodutos < Sreagentes; a transformação ocorre com diminuição da desordem do sistema e tende a ser não-espontânea;
se ∆S = 0, o sistema está em equilíbrio.
Então:
Qualquer evento acompanhado por aumento na entropia do sistema tende acontecer de forma espontânea.
Uma forma de prever se uma reação ocorrerá com aumento ou diminuição de entropia é analisando o estado físico dos reagentes e dos produtos. Como descrito acima, os gases têm mais entropia que os líquidos e estes que os sólidos.
Durante as reações químicas, a liberdade de movimento dos átomos freqüentemente sofre mudanças por causa das alterações na complexidade das moléculas. Vamos considerar a reação representada a seguir:
2NO2(g) → N2O4(g)
Nos reagentes, há seis átomos formando duas moléculas e nos produtos esses mesmos seis átomos estão combinados formando uma molécula. Os seis átomos divididos entre duas moléculas permitem grau maior de liberdade de movimento que os seis átomos formando uma molécula. Então, podemos concluir que essa reação, caso aconteça, ocorrerá com diminuição de entropia.
Duas regras gerais podem ajudar a prever se a entropia nas transformações aumenta ou diminui:
- examinar os estados físicos dos produtos e dos reagentes;
- verificar, quando os estados físicos dos reagentes e produtos forem iguais, o aumento ou a diminuição do número de moléculas após a transformação, o que pode ser feito comparando a quantidade de matéria em mols dos reagentes e dos produtos da reação.



O mínimo de entropia possível corresponde à situação em que átomos de uma substância estariam perfeitamente ordenados em uma estrutura cristalina perfeita. Essa situação deve ocorrer, teoricamente, a 0 K (zero absoluto). Em outras temperaturas, a entropia de uma substância deve ser diferente de zero. Quanto maior a temperatura de uma substância, maior o movimento das suas partículas, mais desorganizada ela está e, portanto, maior a sua entropia.
A entropia (cal/K.mol) a 25 °C para uma mesma substância, a entropia no estado gasoso é maior que aquela no estado líquido, que, por sua vez, é maior que a do estado sólido.
A variação de entropia em uma transformação depende apenas dos estados inicial e final do sistema, independentemente de como os reagentes se transformam nos produtos, isto é, do mecanismo da reação.
Por definição, a variação da entropia de uma transformação é igual à diferença entre a entropia dos produtos e dos reagentes:
∆S = Sprodutos – Sreagentes
Assim:
se ∆S > 0, então Sprodutos > Sreagentes; a transformação ocorre com aumento da desordem do sistema e tende a ser espontânea;
se ∆S < 0, então Sprodutos < Sreagentes; a transformação ocorre com diminuição da desordem do sistema e tende a ser não-espontânea;
se ∆S = 0, o sistema está em equilíbrio.
Então:
Qualquer evento acompanhado por aumento na entropia do sistema tende acontecer de forma espontânea.
Uma forma de prever se uma reação ocorrerá com aumento ou diminuição de entropia é analisando o estado físico dos reagentes e dos produtos. Como descrito acima, os gases têm mais entropia que os líquidos e estes que os sólidos.
Durante as reações químicas, a liberdade de movimento dos átomos freqüentemente sofre mudanças por causa das alterações na complexidade das moléculas. Vamos considerar a reação representada a seguir:
2NO2(g) → N2O4(g)
Nos reagentes, há seis átomos formando duas moléculas e nos produtos esses mesmos seis átomos estão combinados formando uma molécula. Os seis átomos divididos entre duas moléculas permitem grau maior de liberdade de movimento que os seis átomos formando uma molécula. Então, podemos concluir que essa reação, caso aconteça, ocorrerá com diminuição de entropia.
Duas regras gerais podem ajudar a prever se a entropia nas transformações aumenta ou diminui:
- examinar os estados físicos dos produtos e dos reagentes;
- verificar, quando os estados físicos dos reagentes e produtos forem iguais, o aumento ou a diminuição do número de moléculas após a transformação, o que pode ser feito comparando a quantidade de matéria em mols dos reagentes e dos produtos da reação.
A variação da entropia também pode ser medida pela seguinte equação:

Em que:
qrev = energia de forma reversível como calor;
T = temperatura.
T = temperatura.
Visto que a variação da entropia é inversamente proporcional à temperatura, temos que em temperaturas mais baixas, a desorganização será maior.
Outra forma de se calcular a variação da entropia é relacionando-a com o calor:

A variação da entropia é diretamente proporcional à variação da energia, sendo que essa proporcionalidade é dada pela temperatura T.
Segundo Lord Kelvin (William Thomson, 1824-1907), é impossível construir uma máquina térmica em que todo o calor da fonte seja usado integralmente em trabalho, ou seja, seu rendimento nunca será de 100%. A energia que é dissipada na forma de calor se transforma em entropia, aumentando a desordem do sistema.
Temos então que o aumento da entropia é muito importante, pois sem ele nada aconteceria, ele é responsável pela ocorrência dos fenômenos. Isso tem relação com o significado da palavra “entropia”, que vem do grego en, que significa “em” e tropêe, que é “mudança”.
Equação de Gibbs
|
- DG < 0 ® liberação de energia livre ® reação espontânea
- DG > 0 ® absorção de energia livre ® reação não-espontânea
- DG = 0 ® equilíbrio
A energia livre liberada numa reação é a energia máxima que é livre para produzir trabalho útil.
Energia de organização = T·DS
| DH | DS | DG | |
|---|---|---|---|
| + | - | + | (sempre) |
| - | + | - | (sempre) |
| + | + | + - | quando DH > T· DS quando DH < T· DS |
| - | - | + - | quando |DH| < |T· DS| quando |DH| > |T· DS| |
MEDIDA DO CALOR DE REAÇÃO
O calor liberado ou absorvido por um sistema que sofre uma reação química á determinado em aparelhos chamados calorímetros. Estes variam em detalhes e são adaptados para cada tipo de reação que se quer medir o calor. Basicamente, no entanto, um calorímetro é constituído de um recipiente com paredes adiabáticas, contendo uma massa conhecida de parede água, onde se introduz um sistema em reação. O recipiente é provido de um agitador e de um termômetro que mede a variação de temperatura ocorrida durante a reação.
A determinação do calor liberado ou absorvido numa reação química á efetuada através da expressão:
onde:
- Q é a quantidade de calor liberada ou absorvida pela reação. Esta grandeza pode ser expressa em calorias (cal) ou em Joules (J). O Sistema Internacional de Medidas (SI) recomenda a utilização do Joule, no entanto, a caloria ainda é muito utilizada. Uma caloria (1 cal) é a quantidade de calor necessária para fazer com que 1,0 g de água tenha sua temperatura aumentada de 1,0ºC. Cada caloria corresponde a 4,18 J;
- m é a massa, em gramas, de água presente no calorímetro;
- c é o calor especifico do liquido presente no calorímetro. Para a água seu valor é 1 cal/g . ºC;
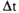 é a variação de temperatura sofrida pela massa de água devido a ocorrência da reação. É medida em graus Celsius.
é a variação de temperatura sofrida pela massa de água devido a ocorrência da reação. É medida em graus Celsius.
A rigor, deve-se considerar a capacidade térmica do calorímetro que inclui, além da capacidade térmica da água, as capacidades térmicas dos materiais presentes no calorímetro (agitador, câmara de reação, fios, termômetro etc.).
O calor de reação pode ser medido a volume constante, num calorímetro hermeticamente fechado, ou à pressão constante, num calorímetro aberto. Experimentalmente, verifica-se que existe uma pequena diferença entre esses dois tipos de medidas calorimétricas. Essa diferença ocorre porque, quando uma reação ocorre à pressão constante, pode haver variação de volume e, portanto, envolvimento de energia na expansão ou contração do sistema.
A variação de energia determinada a volume constante é chamada de variação de energia interna, representada por ΔE, e a variação de energia determinada à pressão constante é chamada de variação de entalpia, representada por ΔH.
Como a maioria das reações químicas são realizadas em recipientes abertos, à pressão atmosférica local, estudaremos mais detalhadamente a variação de entalpia das reações.
Fontes: www.infoescola.com/
www.colegioweb.com.br/
Questões resolvidas sobre Termoquímica
1) (PUC RJ) Considere a seguinte reação termoquímica:
2NO(g) + O2(g) ------- 2NO2(g) AH= -13,5 kcal / mol de NO
e assinale a alternativa falsa.
a) A reação é exotérmica.
b) São libertados 13,5 kcal para cada mol de NO (g) que reagir.
c) A entalpia padrão de formação do O2 (g) é diferente de zero nas condições–padrão.
d) A reação de oxidação do NO (g) pode ocorrer no ar atmosférico.
e) Nenhuma das alternativas é falsa.
2) (FUVEST SP) A dissolução de um sal em água pode ocorrer com liberação de calor, absorção de calor ou sem efeito térmico. Conhecidos os calores envolvidos nas transformações, mostradas no diagrama que segue, é possível calcular o calor da dissolução de cloreto de sódio sólido em água, produzindo Na+(aq) e Cl-(aq).
Com os dados fornecidos, pode-se afirmar que a dissolução de 1 mol desse sal
a) é acentuadamente exotérmica, envolvendo cerca de 103 kJ.
b) é acentuadamente endotérmica, envolvendo cerca de 103 kJ.
c) ocorre sem troca de calor.
d) é pouco exotérmica, envolvendo menos de 10 kJ.
e) é pouco endotérmica, envolvendo menos de 10 kJ.
3) (VUNESP - SP) Em uma cozinha, estão ocorrendo os seguintes processos:
I. gás queimando em uma das “bocas” do fogão e
II. água fervendo em uma panela que se encontra sobre esta “boca” do fogão.
Com relação a esses processos, pode-se afirmar que:
a) I e II são exotérmicos.b) I é exotérmico e II é endotérmico.
c) I é endotérmico e II é exotérmico.d) I é isotérmico e II é exotérmico.
e) I é endotérmico e II é isotérmico.
4) (UNIFESP SP) Com base nos dados da tabela:
Ligação Energia média de ligação (kJ/mol)
O – H 460
H – H 436
O = O 490
pode-se estimar que o DH da reação representada por: 2H2O(g) ® 2H2(g) + O2(g), dado em kJ por mol de H2O(g), é igual a:
a) + 239.b) + 478.c) + 1101.d) – 239.e) – 478.
5) (UFRRJ) Desde a pré-história, quando aprendeu a manipular o fogo para cozinhar seus alimentos e se aquecer, o homem vem percebendo sua dependência cada vez maior das várias formas de energia. A energia é importante para uso industrial e doméstico, nos transportes, etc.
Existem reações químicas que ocorrem com liberação ou absorção de energia, sob a forma de calor, denominadas, respectivamente, como exotérmicas e endotérmicas. Observe o gráfico a seguir e assinale a alternativa correta:
a) O gráfico representa uma reação endotérmica.
b) O gráfico representa uma reação exotérmica.
c) A entalpia dos reagentes é igual à dos produtos.
d) A entalpia dos produtos é maior que a dos reagentes.
e) A variação de entalpia é maior que zero.
6) (UFSC 2010) Considere as seguintes informações sobre entalpia de combustão no estado padrão ΔHo para alguns combustíveis.
| COMBUSTÍVEL | FÓRMULA MOLECULAR | ΔHo (kJ/mol) |
| Gasolina | C8H18(l) | -5400 |
| Etanol | C2H5OH(l) | -1400 |
| Hidrogênio | H2(g) | -290 |
Dados adicionais:
considere a gasolina composta apenas de C8H18; densidade do etanol 0,79 g/mL; e densidade da gasolina 0,72 g/mL.
Com base nas informações acima, assinale a(s) proposição(ões) correta(s).
1) O etanal é um isômero de função do etanol.
2) O nome IUPAC da molécula C8H18 é octanol, alcano de fórmula geral CnH2n.
4) A molécula 2,2,3,3 tetrametilbutano apresenta fórmula molecular C8H18 sendo um isômero do 2,4 dimetilhexano.
8) 2,24 litros de hidrogênio fornecem mais calor que 4,75 mL de gasolina, considerando ambos os combustíveis nas CNTP.
16) Um posto de serviço comercializa o litro de álcool a R$ 1,50 e o litro de gasolina a R$ 2,50. Considerando um carro Flex que consome 1 litro de álcool a cada 10 km ou 1 litro de gasolina a cada 15 km, pode-se concluir que seria mais econômico utilizar o álcool.
32) Comparando-se as entalpias de combustão, é correto afirmar que 57 gramas de gasolina geram mais calor que 46 gramas de etanol ou 20 gramas de hidrogênio.
7) (PUC-RJ) A combustão completa do etino (mais conhecido como acetileno) é representada na equação abaixo.
Assinale a alternativa que indica a quantidade de energia, na forma de calor, que é liberada na combustão de 130 g de acetileno, considerando o rendimento dessa reação igual a 80%.
a) −12.550 kJ
b) − 6.275 kJ
c) − 5.020 kJ
d) − 2.410 kJ
e) − 255 kJ
8) (UDESC 2010) Dados os calores de reação nas condições padrões para as reações químicas abaixo:

Pode-se afirmar que a entalpia padrão do acetileno, em kcal/mol, é:
a) –310,6
b) –222,5
c) –54,3
d) +54,3
e) +222,5
9) (PUC-RJ) Considere calor de neutralização como a variação de entalpia na reação de um mol de H+ com um mol de OH-, formando um mol de H2O. Um experimento envolveu a reação de 2,00 g de NaOH contido em solução aquosa de hidróxido de sódio com HCl suficiente para reação completa, contido em solução aquosa de ácido clorídrico, representada na equação abaixo:
Um estudante, usando os valores obtidos no experimento e a expressão Q = m.c.DT, encontrou para esta reação a liberação de 660 cal. Sabendo-se que 1 cal equivale a 4,18 J, é correto afirmar que a variação de entalpia de neutralização, em kJ mol-1, é, de acordo com os algarismos significativos dos valores medidos, igual a:
a) 13,2.
b) 26,4.
c) 55,2.
d) 110.
e) 330.
I. Entalpia (H) pode ser conceituada como a energia global de um sistema.
II. Uma reação exotérmica apresenta D H positivo.
III. O calor de reação de um processo químico será dado por D H.
a) somente I é correta
b) somente II é correta
c) somente III é correta
d) as afirmativas I e II são corretas
e) as afirmativas I e III são corretas.
b) 26,4.
c) 55,2.
d) 110.
e) 330.
10) (OSEC) Analise as afirmativas abaixo:
I. Entalpia (H) pode ser conceituada como a energia global de um sistema.
II. Uma reação exotérmica apresenta D H positivo.
III. O calor de reação de um processo químico será dado por D H.
a) somente I é correta
b) somente II é correta
c) somente III é correta
d) as afirmativas I e II são corretas
e) as afirmativas I e III são corretas.
11) (BRASÍLIA) A energia de ligação média para a ligação C – H no metano CH4(g) é aproximadamente:
Dado: DHf0 (entalpia de formação-padrão)
CH4(g) = -17,9 kcal/mol
H(g) = +52,1 kcal/mol
C(g) = +170,9 kcal/mol
a) +99 kcal/mol
b) +60 kcal/mol
c) +73 kcal/mol
d) +397 kcal/mol
12) (PUC) Considerando a reação dada pela equação H2(g) + I2(g) e sabendo que as entropias-padrão, nas condições da reação são:
- para o H2(g): 31,2 cal/K . mol
- para o I2(g): 27,9 cal/K . mol
- para o HI(g): 49,3 cal/K . mol
Podemos concluir que a variação de entropia na reação dada, por mol de HI formado, em cal/K . mol, é igual a:
a) –4,9
b) –9,8
c) +19,7
d) +39,5
e) +108,4
- para o H2(g): 31,2 cal/K . mol
- para o I2(g): 27,9 cal/K . mol
- para o HI(g): 49,3 cal/K . mol
Podemos concluir que a variação de entropia na reação dada, por mol de HI formado, em cal/K . mol, é igual a:
a) –4,9
b) –9,8
c) +19,7
d) +39,5
e) +108,4
13) Pode uma transformação apresentar diminuição de entalpia e diminuição de entropia ser espontânea?
14) (Unicamp 2007 - 2a fase) Quando se utiliza um biossistema integrado numa propriedade agrícola, a biodigestão é um dos processos essenciais desse conjunto. O biodigestor consiste de um tanque, protegido do contato com o ar atmosférico, onde a matéria orgânica de efluentes, principalmente fezes animais e humanas, é metabolizada por bactérias. Um dos subprodutos obtidos nesse processo é o gás metano, que pode ser utilizado na obtenção de energia em queimadores. A parte sólida e líquida que sobra é transformada em fertilizante. Dessa forma, faz-se o devido tratamento dos efluentes e ainda se obtêm subprodutos com valor agregado.
a) Sabe-se que a entalpia molar de combustão do metano é de -803 kJ/mol; que a entalpia molar de formação desse mesmo gás é de -75 kJ/mol; que a entalpia molar de formação do CO2 é de -394 kJ/mol. A partir dessas informações, calcule a entalpia molar de formação da água nessas mesmas condições.
No aparelho digestório de um ruminante ocorre um processo de fermentação de hexoses, semelhante ao que ocorre nos biodigestores. A equação abaixo tem sido utilizada para representar essa fermentação:
58 C6H12O6 → 63 CH3COOH + 24 CH3CH2COOH + 13 CH3CH2CH2COOH + 62,5 CO2 + 35,5 CH4 + 27 H2O
b) Considere a seguinte informação: "o processo de fermentação digestiva de ruminantes contribui para o aquecimento global". Você concorda? Responda SIM ou NÃO e explique sua resposta.
c) Qual seria o número de moles de gás metano produzido na fermentação de 5,8 quilogramas de hexose ingeridos por um ruminante?
15) A energia térmica envolvida nas reações químicas é geralmente expressa em termos da variação de:
19) Durante a produção industrial do ácido sulfúrico são necessárias as seguintes etapas intermediárias: combustão do enxofre e oxidação do dióxido de enxofre.
26) São dadas as seguintes energias de ligação em kJ/mol de ligação formada:
27) Dado:
Calor de combustão de H2
(g) = –68 kcal/mol
Calor de combustão de CH4
(g) = –213 kcal/mol
Qual dos dois combustíveis libertaria maior quantidade de calor por grama?
(C = 12, H = 1)
28) Determine a entalpia de combustão do metanol líquido, a 25°C e 1atm, em kJ/mol, sendo dados:
∆H = –239 kJ/mol
∆H = –286 kJ/mol
Cgraf+ O2
(g) → CO2
(g) ∆H = –393 kJ/mol
29) (UNIFEI-MG) Considerando os dados de entalpia de ligação abaixo, o calor associado (kJ/mol) à reação:
CH4(g) 4Cl2(g) CCl4(g) 4 HCl (g), à pressão constante, deverá ser :
(C – H = 414 kJ/mol, H – Cl = 431 kJ/mol, Cl – Cl = 243 kJ/mol, C – Cl = 331 kJ/mol)
a) + 420 kJ/mol
b) + 105 kJ/mol
c) – 105 kJ/mol
d) – 420 kJ/mol
30) (PUC MG) Dadas as seguintes equações termoquímicas, a 25ºC e 1 atm:
C2H2(g) + 5/2 O2(g) 2CO2(g) + H2O(l) H1 = – 1301,0 kJ/mol
C2H6(g) + 7/2 O2(g) 2CO2(g) + 3H2O(l) H2 = – 1560,0 kJ/mol
H2(g) + 1/2O2(g) H2O(l) H3 = –286,0 kJ/mol
Assinale a variação de entalpia (H), em kJ, para a reação C2H2(g) + 2 H2(g) C2H6(g).
a) – 313,0
b) – 27,0
c) + 313,0
d) + 27,0
31) Calcular a variação de entalpia na reação: CH4 + 2O2 à CO2 + 2H2O, utilizando as entalpias de formação, em kcal/mol: CH4=–17,9; CO2=–94,1 e H2O=–68,3.
32) determinar o calor de formação da amônia gasosa.
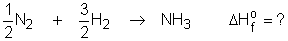
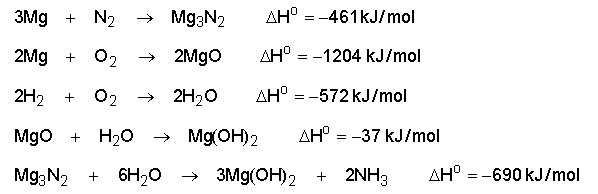
Gabarito:
a) entalpia.
b) entropia.
c) estados de agregação.
d) volume.
e) temperatura.
16) O conteúdo energético de um sistema é denominado entalpia. Em uma reação endotérmica, ocorre absorção de energia . Numa reação endotérmica, portanto a entalpia dos reagentes é;
A- Maior ou igual à dos produtos.
B- Menor que à dos produtos.
C- Impossível de ser comparada com a entalpia dos produtos.
D- Igual à dos produtos.
E- Maior que a dos produtos.
A- Maior ou igual à dos produtos.
B- Menor que à dos produtos.
C- Impossível de ser comparada com a entalpia dos produtos.
D- Igual à dos produtos.
E- Maior que a dos produtos.
17) Nas pizzarias há cartazes dizendo "Forno a lenha". A reação que ocorre neste forno para assar a pizza é:
A- Explosiva.
B- Exotérmica.
C- Endotérmica.
D- Higroscópica.
E- Catalizada.
A- Explosiva.
B- Exotérmica.
C- Endotérmica.
D- Higroscópica.
E- Catalizada.
18) Considerando-se a transformação isotérmica N2O(g) ® N2(g) + O2(g) à 25°C e sabendo-se que a variação de entalpia (DH) é –19,5 kcal/mol e que a variação de entropia (DS) é 18 cal/grau . mol, podemos afirmar que a variação de energia livre (DG) do sistema é
2 S(s) + 3 O2(g) → 2 SO3(g) ∆H = -791,44 kJ
S(s) + O2(g) → SO2(g) ∆H = -296,83 kJ
Determine a entalpia padrão de formação do trióxido de enxofre de acordo com a reação abaixo:
2 SO2(g) + O2(g) → 2 SO3(g)
a) – 197,78 kJ
b) – 1088,27 kJ
c) + 197,78 kJ
d) – 494,61 kJ
e) + 1088,27 kJ
20) Considere as seguintes equações termoquímicas:
N2(g) + 3 O2(g) + H2(g) → 2 HNO3(aq) ∆H = -415 kJ
2 H2(g) + O2(g) → 2 H2O(l) ∆H = -572 kJ
N2O5(g) + H2O(l) → 2 HNO3(aq) ∆H = -140 kJ
A entalpia de formação do pentóxido de nitrogênio, em kJ/mol, é igual a
a) –847.
b) –11,0.
c) +11,0.
d) +22,0.
e) +847.
21) Quando o óxido de magnésio está na presença de uma atmosfera de gás carbônico, este é convertido a carbonato de magnésio.
São dadas as entalpias-padrão de formação:
Mg(s) + ½ O2(g) → MgO(s) ∆H = -602 kJ/mol
C(graf) + O2(g) → CO2(g) ∆H = -394 kJ/mol
Mg(s) + C(graf) + 3/2 O2(g) → MgCO3(s) ∆H = -1096 kJ/mol
A formação de um mol de carbonato de magnésio, a partir do óxido de magnésio e gás carbônico, é uma reação
a) endotérmica, com valor absoluto de entalpia de 100 kJ.
b) exotérmica, com valor absoluto de entalpia de 100 kJ.
c) endotérmica, com valor absoluto de entalpia de 888 kJ.
d) exotérmica, com valor absoluto de entalpia de 888 kJ.
e) endotérmica, com valor absoluto de entalpia de 1 304 kJ.
22) Dadas as equações termoquímicas:
C(graf) + O2(g) → CO2(g) ∆H = -393 kJ/mol
H2(g) + ½ O2(g) → H2O(l) ∆H = -286,0 kJ/mol
2 C(graf) + 2 H2(g) + O2(g) → CH3COOH(l) ∆H = -484,0 kJ
A entalpia-padrão de combustão de um mol de ácido acético é
a) + 874 kJ.
b) +195 kJ.
c) –195 kJ.
d) –874 kJ.
e) –1163 kJ.
23) Com o objetivo de solucionar o problema da grande demanda de energia proveniente de fontes energéticas não-renováveis, uma das alternativas propostas é o uso da biomassa, matéria orgânica que quando fermenta, produz biogás, cujo principal componente é o metano, utilizado em usinas termelétricas, gerando eletricidade, a partir da energia térmica liberada na sua combustão.
O calor envolvido, em kJ, na combustão de 256 g do principal componente do biogás é, aproximadamente,
Dados:
C(graf) + 2H2(g) → CH4(g) ∆H = -74,4 kJ/mol
H2(g) + ½ O2(g) → H2O(g) ∆H = -242,0 kJ/mol
C(graf) + O2(g) → CO2(g) ∆H = -393,5 kJ/mol
a) –801,0.
b) +1.606,0.
c) –6.425,0.
d) +8.120,0.
e) –13.010,0.
24) (FUVEST) O Benzeno pode ser obtido a partir de hexano por reforma catalítica. Considere as reações de combustão:
H2(g) + ½ O2(g) -> H2O(l) ΔH = -286 KJ/mol
C6H6(l) + 15/2 O2(g) -> 6CO2(g) + 3H2O(l) ΔH = -3268 KJ/mol
C6H14(l) + 19/2 O2(g) -> 6CO2(g) + 7H2O(l) ΔH = -4163 KJ/mol
Pode-se então afirmar que na formação de 1 mol de benzeno, a partir do hexano, há:
- Liberação de 249 KJ
- Absorção de 249 KJ
- Liberação de 609 KJ
- Absorção de 609 KJ
- Liberação de 895 KJ
25) Sabendo que:
HCℓ(g) → H(g) + Cℓ(g) ∆H = +431 kJ
Determine a energia de ligação entre o carbono e o hidrogênio.
H ─ Cℓ = - 431,8; H ─ F = - 563,2;
Cℓ ─ Cℓ = - 242,6; F ─ F = - 153,1.
Com os dados acima é possível prever que a reação a seguir:
Cℓ ─ Cℓ = - 242,6; F ─ F = - 153,1.
Com os dados acima é possível prever que a reação a seguir:
2 HCℓ(g) + 1 F2(g) → 2 HF(g) + 1 Cℓ(g)
teria ∆H, em kJ, da ordem de:
a) - 585,9;
b) - 352,3;
c) - 220,9;
d) + 220,9;
e) + 352,3.
a) - 585,9;
b) - 352,3;
c) - 220,9;
d) + 220,9;
e) + 352,3.
Calor de combustão de H2
(g) = –68 kcal/mol
Calor de combustão de CH4
(g) = –213 kcal/mol
Qual dos dois combustíveis libertaria maior quantidade de calor por grama?
(C = 12, H = 1)
28) Determine a entalpia de combustão do metanol líquido, a 25°C e 1atm, em kJ/mol, sendo dados:
∆H = –239 kJ/mol
∆H = –286 kJ/mol
Cgraf+ O2
(g) → CO2
(g) ∆H = –393 kJ/mol
29) (UNIFEI-MG) Considerando os dados de entalpia de ligação abaixo, o calor associado (kJ/mol) à reação:
CH4(g) 4Cl2(g) CCl4(g) 4 HCl (g), à pressão constante, deverá ser :
(C – H = 414 kJ/mol, H – Cl = 431 kJ/mol, Cl – Cl = 243 kJ/mol, C – Cl = 331 kJ/mol)
a) + 420 kJ/mol
b) + 105 kJ/mol
c) – 105 kJ/mol
d) – 420 kJ/mol
30) (PUC MG) Dadas as seguintes equações termoquímicas, a 25ºC e 1 atm:
C2H2(g) + 5/2 O2(g) 2CO2(g) + H2O(l) H1 = – 1301,0 kJ/mol
C2H6(g) + 7/2 O2(g) 2CO2(g) + 3H2O(l) H2 = – 1560,0 kJ/mol
H2(g) + 1/2O2(g) H2O(l) H3 = –286,0 kJ/mol
Assinale a variação de entalpia (H), em kJ, para a reação C2H2(g) + 2 H2(g) C2H6(g).
a) – 313,0
b) – 27,0
c) + 313,0
d) + 27,0
31) Calcular a variação de entalpia na reação: CH4 + 2O2 à CO2 + 2H2O, utilizando as entalpias de formação, em kcal/mol: CH4=–17,9; CO2=–94,1 e H2O=–68,3.
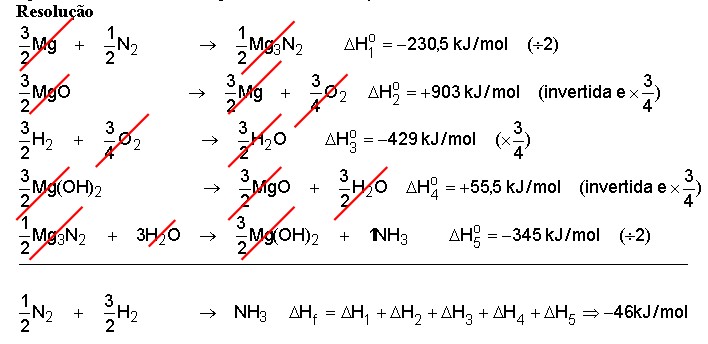
32) determinar o calor de formação da amônia gasosa.
São conhecidas as seguintes reações:

1) C 2) E 3) B 4) A 5) B 6) 4 e 16 7) C 8) D 9) C 10) E 11) A 12) C 13) sim
14)

15) B 16) B 17) B 18) 24,86 kcal e espontâneo 19) A 20) C 21) B 22) D 23) E
24)
26) Alternativa “b”.
14)

15) B 16) B 17) B 18) 24,86 kcal e espontâneo 19) A 20) C 21) B 22) D 23) E
24)
- Inverte-se a primeira equação multiplicando por 4
- Inverte-se a segunda equação
- A terceira equação permanece a mesma
(H2O(l) -> H2(g) + ½ O2(g)).4 (ΔH = +286 KJ/mol).4
6CO2(g) + 3H2O(l) -> C6H6(l) + 15/2 O2(g) ΔH = +3268 KJ/mol +
C6H14(l) + 19/2 O2(g) -> 6CO2(g) + 7H2O(l) ΔH = -4163 KJ/mol
______________________________________________________________
C6H14(l) -> C6H6(l) + 4H2(g) ΔH = +249 KJ/mol
Assim, a alternativa B está correta: ocorre absorção de 249 KJ a cada mol de benzeno formado.
25) A estrutura da substância HCℓ(g) é H ─ Cℓ. Para formar o hidrogênio e o cloro isolados, é necessário romper essa ligação. Como nenhuma ligação é formada na reação fornecida, a entalpia da reação é igual à energia absorvida no rompimento das ligações da molécula de HCℓ:
∆H = energia de ligação em HCℓ = +431 kJ
Vamos por etapas:
Primeiro vamos determinar o ∆H que foi absorvido no rompimento das ligações dos reagentes:
2 mol de ligações H ─ Cℓ: 2 . (+ 431,8) kJ
1 mol de ligações F ─ F: 1 . (+153,1) kJ
∆Henergia total absorvida = 1016,7 kJ (o sinal positivo indica que a reação é endotérmica, está havendo absorção de energia porque as ligações estão sendo rompidas).
1 mol de ligações F ─ F: 1 . (+153,1) kJ
∆Henergia total absorvida = 1016,7 kJ (o sinal positivo indica que a reação é endotérmica, está havendo absorção de energia porque as ligações estão sendo rompidas).
Agora vamos determinar o ∆H que foi liberado na formação das ligações do produto:
2 mol de ligações H ─ F: 2 . (-563,2) kJ
1 mol de ligações Cℓ ─ Cℓ: 1 . (- 242,6) kJ
∆Henergia total liberada = - 1369 kJ (o sinal negativo indica que a reação é exotérmica, está havendo liberação de energia porque as ligações estão sendo formadas).
1 mol de ligações Cℓ ─ Cℓ: 1 . (- 242,6) kJ
∆Henergia total liberada = - 1369 kJ (o sinal negativo indica que a reação é exotérmica, está havendo liberação de energia porque as ligações estão sendo formadas).
Agora basta somar esses valores para descobrir o ∆H da reação:
∆H =∆Henergia total absorvida + ∆Henergia total liberada
∆H = (1016,7 + (- 1369) kJ)
∆H = - 352,3 kJ
27)
H2 2 g —— (– 68) kcal
1 g —— x
x = – 34 kcal
CH4 16 g libera 213
1 g libera y
y = 13,3 kcal
Resposta: H2
28)
CH3OH + O2 →CO2 + 2H2O ∆ H = ?
CH3OH → C + 2H2 + O2 ∆ H1 = + 239
C + O2 →CO2 ∆ H2= – 393
x2 {2H2 + O2 → 2H2O ∆H3 = 2 (– 286)
CH3OH + O2 → CO2 + 2H2O ∆ H = ?
∆H = ∆H1 + ∆H2 + ∆H3
∆H = – 726 kJ/mol
Obs.: Pode ser resolvido pelo método dos Calores de formação:
CH3OH + O2 → CO2 + 2H2O ∆H = ?
–239 zero – 393 2(– 286)
Hinicial Hfinal
∆H = [– 393 + 2(–286)] – [– 239]
H = – 726 kJ
29) D
30) A
31)

H2 2 g —— (– 68) kcal
1 g —— x
x = – 34 kcal
CH4 16 g libera 213
1 g libera y
y = 13,3 kcal
Resposta: H2
28)
CH3OH + O2 →CO2 + 2H2O ∆ H = ?
CH3OH → C + 2H2 + O2 ∆ H1 = + 239
C + O2 →CO2 ∆ H2= – 393
x2 {2H2 + O2 → 2H2O ∆H3 = 2 (– 286)
CH3OH + O2 → CO2 + 2H2O ∆ H = ?
∆H = ∆H1 + ∆H2 + ∆H3
∆H = – 726 kJ/mol
Obs.: Pode ser resolvido pelo método dos Calores de formação:
CH3OH + O2 → CO2 + 2H2O ∆H = ?
–239 zero – 393 2(– 286)
Hinicial Hfinal
∆H = [– 393 + 2(–286)] – [– 239]
H = – 726 kJ
29) D
30) A
31)

32)





Nenhum comentário:
Postar um comentário